Chẩn đoán hội chứng kháng phospholipid (uptodate)
Các tác giả: Doruk Erkan, MD, MPH; Thomas L Ortel, MD, PhD
GIỚI THIỆU
Hội chứng kháng phospholipid (APS) được đặc trưng bởi huyết khối tĩnh mạch hoặc động mạch và / hoặc các bất lợi trong quá trình mang thai khi có bằng chứng xét nghiệm dai dẳng về kháng thể kháng phospholipid (aPL). APS xảy ra như một tình trạng chính hoặc trong bệnh cảnh của một bệnh lý có từ trước, thường là lupus ban đỏ hệ thống (SLE).
Kháng thể kháng phospholipid – aPL là một nhóm kháng thể không đồng nhất chống lại các protein liên kết phospholipid [2]. Các xét nghiệm phát hiện aPL có trong tiêu chí phân loại APS là kháng thể kháng Cardiolipin (aCL) IgG hoặc IgM ELISA, kháng thể kháng beta2-glycoprotein (GP) I (IgG hoặc IgM) ELISA, và xét nghiệm chất kháng đông lupus (LA). Mặc dù Cardiolipin là một phospholipid, hầu hết các kháng thể có liên quan về mặt lâm sàng được phát hiện trong xét nghiệm này thực sự liên kết với (các) protein liên kết phospholipid, thường là beta2-GP I, liên kết với cardiolipin trong xét nghiệm. Có các aPL khác không được bao gồm trong tiêu chí phân loại APS (ví dụ, các kháng thể chống lại prothrombin, phosphatidylserine, hoặc phosphatidylinositol), không được thu thập thường xuyên vì thiếu xét nghiệm chuẩn hóa và không chắc chắn về ý nghĩa lâm sàng của chúng.
KHI NÀO NGHI NGỜ CHẨN ĐOÁN
Hai tình huống lâm sàng có thể nghi ngờ hội chứng kháng phospholipid (APS) là:
- Xuất hiện một hoặc nhiều biến cố huyết khối tĩnh mạch hoặc động mạch không rõ nguyên nhân, đặc biệt ở bệnh nhân trẻ tuổi.
- Một hoặc nhiều lần mang thai không thuận lợi, bao gồm thai chết lưu sau 10 tuần tuổi thai, sinh non do tiền sản giật nặng hoặc suy nhau thai, hoặc mất nhiều phôi (tuổi thai <10 tuần).
Nếu một trong hai trường hợp trên xảy ra ở một bệnh nhân có biểu hiện bệnh livedo reticularis, bệnh van tim và / hoặc các phát hiện về thần kinh như suy giảm nhận thức và tổn thương chất trắng, thì càng làm tăng khả năng chẩn đoán APS. Chẩn đoán bệnh tự miễn hệ thống, đặc biệt là bệnh lupus ban đỏ hệ thống (SLE), nên được nghĩ tới nếu có APS cùng các triệu chứng lâm sàng thích hợp.
Ngoài ra, các bất thường xét nghiệm có ý nghĩa gợi ý chẩn đoán các tình huống trên bao gồm giảm tiểu cầu nhẹ không giải thích được, kéo dài thời gian xét nghiệm đông máu APTT, hoặc tiền sử xét nghiệm huyết thanh dương tính giả với bệnh giang mai.
Chúng tôi thường không xét nghiệm aPL ở những bệnh nhân có nguy cơ mắc APS thấp, chẳng hạn như bệnh nhân người lớn tuổi có biểu hiện huyết khối tĩnh mạch hoặc đột quỵ và / hoặc những cá nhân có các yếu tố nguy cơ thuyên tắc huyết khối khác [3].
CHẨN ĐOÁN
Ở những bệnh nhân nghi ngờ mắc hội chứng kháng phospholipid (APS), cần tiến hành kiểm tra bệnh sử kỹ lưỡng, khám lâm sàng và xét nghiệm tìm kháng thể kháng phospholipid (aPL) [4].
Tiền sử
Bệnh sử nên tập trung vào bản chất và tần suất của các biến cố huyết khối, kết quả mang thai ở bệnh nhân nữ, giảm tiểu cầu và các yếu tố nguy cơ khác gây huyết khối, có thể bao gồm bất động, sử dụng thuốc tránh thai và / hoặc tiền sử gia đình mắc bệnh huyết khối. Tiền sử tiếp xúc với heparin có thể liên quan ở những bệnh nhân có khả năng bị giảm tiểu cầu do heparin (HIT). Bệnh sử cũng nên bao gồm các câu hỏi về các triệu chứng liên quan đến bệnh lupus ban đỏ hệ thống (SLE) như nhạy cảm với ánh sáng, loét miệng, rụng tóc loang lổ và hiện tượng Raynaud.
Khám lâm sàng
Có thể tìm thấy các đặc điểm bất thường khi khám liên quan đến thiếu máu cục bộ hoặc nhồi máu da, nội tạng hoặc hệ thần kinh trung ương. Việc khám lâm sàng có thể cho thấy những phát hiện phù hợp với bệnh livedo reticularis, thiếu máu cục bộ, hoại tử, huyết khối tĩnh mạch sâu, tiếng thổi ở tim, hoặc bất thường thần kinh gợi ý đột quỵ.

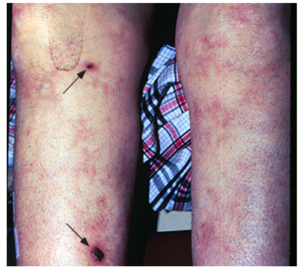
Hình ảnh bệnh nhân bị lupus và có kháng thể kháng phospholipid với liveoreticularis (biểu hiện bằng da có màu tím tái, hình lưới) dẫn đến hình thành vết loét (mũi tên).
Xét nghiệm kháng thể kháng phospholipid
Xét nghiệm kháng thể ở bệnh nhân nghi ngờ APS bao gồm xét nghiệm miễn dịch tìm kháng thể IgG và IgM đối với cardiolipin và beta2-Glycoprotein I, xét nghiệm kháng đông lupus (LA) [5]:
- Kháng thể anticardiolipin (aCL); IgG và IgM bằng xét nghiệm hấp thụ miễn dịch liên kết với enzym (ELISA).
- Kháng thể kháng beta2-GP I; IgG và IgM bằng ELISA.
- Xét nghiệm LA là một quy trình gồm ba bước:
- Các xét nghiệm sàng lọc phụ thuộc phospholipid kéo dài bao gồm dRVVT, aPTT ( đã được tối ưu hóa cho mục đích này).
- Trộn huyết tương bệnh nhân với huyết tương bình thường không hiệu chỉnh được (các) xét nghiệm sàng lọc kéo dài. Điều này loại trừ khả năng kéo dài thời gian xét nghiệm sàng lọc là do thiếu hụt yếu tố đông máu. Nếu xét nghiệm đông máu vẫn kéo dài sau khi bổ sung huyết tương bình thường, thì có chất ức chế.
- Việc bổ sung phospholipid dư thừa sẽ rút ngắn hoặc điều chỉnh thử nghiệm đông máu kéo dài (chứng minh sự phụ thuộc vào phospholipid).
Thử nghiệm aPL ở trên phù hợp với các khuyến nghị từ các tiêu chí phân loại Sapporo đã sửa đổi được mô tả bên dưới.
Ngược lại với các isotype IgG và IgM của aCL và anti-beta2-GP I, mối liên hệ của các isotype IgA với huyết khối lâm sàng vẫn còn nhiều tranh cãi [ 6 ]. Chúng tôi thường không xét nghiệm các isotype IgA khi đánh giá APS và chúng tôi thường không coi các kháng thể này là bằng chứng hỗ trợ cho việc chẩn đoán APS nếu chúng được báo cáo. IgA isotype có thể có ý nghĩa đối với phân loại SLE vì nó phổ biến hơn ở bệnh nhân SLE, so với bệnh nhân dương tính với aPL không mắc các bệnh tự miễn khác [9].
Chúng tôi không thường xuyên thực hiện xét nghiệm các kháng thể khác như kháng thể antiprothrombin, kháng thể kháng annexin V, kháng phosphatidylserine và kháng phosphatidylinositol, do thiếu xét nghiệm tiêu chuẩn hóa và không chắc chắn về ý nghĩa lâm sàng của chúng [7].
Thời điểm xét nghiệm
Xét nghiệm đầu tiên thường được thực hiện ngay sau khi có một sự kiện lâm sàng, tiếp theo là xét nghiệm khẳng định ít nhất 12 tuần sau đó.
- Xét nghiệm aPL lần đầu– Thông thường, xét nghiệm aPL lần đầu được thực hiện tại thời điểm có huyết khối hoặc kết quả thai nghén bất lợi. Cần lưu ý rằng sự hiện diện của huyết khối lớn có thể làm sai lệch kết quả xét nghiệm aPTT. Do đó, xét nghiệm aPTT bình thường hoặc xét nghiệm sàng lọc LA khác trong giai đoạn cấp tính có thể không chính xác và cần lặp lại. Các xét nghiệm miễn dịch (xét nghiệm ELISA cho aCL hoặc beta-2-GP I) không bị ảnh hưởng bởi huyết khối cấp tính hoặc sử dụng thuốc chống đông máu.
- Xét nghiệm khẳng định aPL– Ở những bệnh nhân có xét nghiệm dương tính ban đầu với aPL, xét nghiệm nên được lặp lại sau ít nhất 12 tuần để xác nhận sự tồn tại của aCL, anti-beta2-GPI hoặc LA. Nồng độ IgG hoặc IgM aCL tăng cao nhất thời, cũng như xét nghiệm LA dương tính, có thể xảy ra trong bối cảnh một số bệnh nhiễm trùng hoặc dùng thuốc.
Kết quả dương tính aPL trên hai thử nghiệm cách nhau ≥12 tuần đáp ứng các tiêu chí phòng thí nghiệm để phân loại APS. Đối với phần lớn bệnh nhân không có bằng chứng xét nghiệm về APS từ xét nghiệm này, chúng tôi không thực hiện xét nghiệm kháng thể bổ sung. Tuy nhiên, xét nghiệm lặp lại có thể thích hợp trong một số trường hợp nhất định khi nghi ngờ lâm sàng đối có APS đặc biệt cao.
Sự cần thiết phải xét nghiệm khẳng định do tính chất thoáng qua của aPL đã được minh họa trong một nghiên cứu bao gồm những người hiến máu được chọn ngẫu nhiên đã được xét nghiệm sự hiện diện của aCL và LA [ 10 ]. Trong thử nghiệm ban đầu, 28 trong số 503 (5,6%) dương tính với IgG aCL, 38 trong số 457 (8,3%) dương tính với IgM aCL, và thêm 5 (0,9%) dương tính với cả hai. Số người vẫn dương tính với aCL khi thử nghiệm lặp lại giảm dần ở 3, 6, 9 và 12 tháng; tại một năm, chỉ có bốn trường hợp dương tính với IgG aCL (0,8%), một với IgM aCL (0,2%), và không có trường hợp nào dương tính cả hai isotype. Không có cá nhân nào có LA dương tính, và không một cá nhân nào có bằng chứng lâm sàng về APS.
Bệnh nhân đang dùng thuốc chống đông máu
Ở những bệnh nhân đang dùng thuốc chống đông máu, chúng tôi xét nghiệm tìm kháng thể kháng aCL và kháng beta2-GP I vì kết quả không bị ảnh hưởng bởi sự hiện diện của thuốc chống đông máu. Như đã nói ở trên, thuốc chống đông máu có thể kéo dài aPTT và làm cho việc giải thích aPTT hoặc xét nghiệm sàng lọc LA khác trở nên khó khăn hơn.
Ảnh hưởng của thuốc chống đông lên các xét nghiệm đông máu
| Drug class | Drug | Brand name(s) | PT | aPTT | Anti-factor Xa activity |
| Vitamin K antagonists | Warfarin | Coumadin, Jantoven | ↑ | ↑/– | – |
| Acenocoumarol | Sintrom | ↑ | ↑/– | – | |
| Heparins | Unfractionated heparin | – | ↑ | ↑ | |
| LMW heparinsEnoxaparin
Dalteparin Nadroparin |
Lovenox
Fragmin Fraxiparine |
– | ↑/– | ↑ | |
| Fondaparinux | Arixtra | – | ↑/– | ↑ | |
| Direct thrombin inhibitors | Argatroban | Acova | ↑ | ↑ | – |
| Dabigatran | Pradaxa | ↑/– | ↑ | – | |
| Direct factor Xa inhibitors | Rivaroxaban | Xarelto | ↑/– | ↑/– | ↑ |
| Apixaban | Eliquis | ↑/– | ↑/– | ↑ | |
| Edoxaban | Lixiana, Savaysa | ↑ | |||
| Betrixaban | Bevyxxa | ↑ |
Giải thích kết quả dương tính
Không phải mọi kết quả xét nghiệm aPL dương tính đều có ý nghĩa về mặt lâm sàng. Việc giải thích “tính dương tính aPL có ý nghĩa lâm sàng” cần tính đến loại, isotype, nồng độ, độ bền và số lượng test aPL dương tính.
- Định nghĩa một hồ sơ aPL có ý nghĩa lâm sàng là sự hiện diện của một hoặc nhiều aPL sau đây trong hai hoặc nhiều lần cách nhau ít nhất 12 tuần:
- Xét nghiệm LA dương tính, dựa trên hướng dẫn của ISTH.
- aCL IgG hoặc IgM, với hiệu giá > 40 đơn vị
- anti-beta2-GP I IgG hoặc IgM, với hiệu giá> 40 đơn vị
Cách tiếp cận này hầu hết phù hợp với các tiêu chí phân loại APS của Sapporo đã sửa đổi.
- Ở những bệnh nhân nhất định có nghi ngờ lâm sàng đặc biệt cao về APS, có thể xem xét các phát hiện sau là có ý nghĩa lâm sàng:
- aCL hoặc kháng beta2-GP I IgG hoặc IgM, với hiệu giá từ 20 đến 39 đơn vị
- aCL hoặc kháng beta2-GP I IgA
Lưu ý, aPL cũng có thể xuất hiện trong các bệnh cảnh khác ngoài APS, tạm thời hoặc lâu dài, sẽ được thảo luận chi tiết hơn bên dưới.
Đánh giá các điều kiện khác
Việc chẩn đoán APS đòi hỏi vài tháng do cần phải có xét nghiệm để khẳng định, và trong thời gian chờ, có thể cần bổ sung các xét nghiệm đánh giá nguyên nhân khác gây ra huyết khối tắc mạch và / hoặc thai nghén bất lợi.
Các xét nghiệm bổ sung có thể bao gồm:
- Xét nghiệm huyết khối– Xét nghiệm huyết khối có thể thích hợp ở một số bệnh nhân như xét nghiệm đột biến yếu tố V Leiden, đột biến prothrombin G20210A; thiếu protein S, protein C và antithrombin; ung thư tăng sinh tủy (MPN); hoặc đái ra huyết sắc tố kịch phát về đêm (PNH).
- Đánh giágiảm tiểu cầu không rõ nguyên nhân – Bệnh nhân bị giảm tiểu cầu không rõ nguyên nhân hoặc thiếu máu nên được đánh giá về các nguyên nhân tiềm ẩn khác của những bất thường này.
- Đánh giá bệnh lupus ban đỏ hệ thống– Bệnh nhân có các đặc điểm lâm sàng khác gợi ý đến SLE cũng nên được điều trị thích hợp cho SLE. Trong một nhóm thuần tập gồm 1000 người mắc APS, 36% mắc SLE và thêm 5% mắc hội chứng giống lupus [ 11].
- Đánh giá tình trạng giảm tiểu cầu do heparin– Bệnh nhân có các đặc điểm lâm sàng gợi ý HIT nên được đánh giá HIT thích hợp.
TIÊU CHÍ PHÂN LOẠI
Tiêu chí phân loại cho hội chứng kháng phospholipid (APS) đã được phát triển để lựa chọn bệnh nhân cho các mục đích nghiên cứu lâm sàng và phòng thí nghiệm [ 12,13 ]. Mặc dù các tiêu chí phân loại không nên được sử dụng cho mục đích chẩn đoán, nhưng chúng có thể hữu ích để hướng dẫn bác sĩ lâm sàng chẩn đoán bệnh nhân và ghi lại các đặc điểm chính của bệnh [ 14,15 ]. Tuy nhiên, việc sử dụng các tiêu chí này không nên thay thế cho đánh giá lâm sàng khi chẩn đoán APS.
Tiêu chí phân loại APS của Sapporo đã sửa đổi (còn gọi là tiêu chí Sydney), APS có ở những bệnh nhân đáp ứng ít nhất một trong các tiêu chí lâm sàng và ít nhất một trong các tiêu chí xét nghiệm sau:
- Tiêu chí lâm sàng– Có một hoặc nhiều điều sau:
– Huyết khối mạch máu – Một hoặc nhiều đợt huyết khối tĩnh mạch, động mạch hoặc mạch nhỏ trong bất kỳ ở mô hoặc cơ quan nào, với hình ảnh rõ ràng hoặc bằng chứng mô học về huyết khối. Huyết khối tĩnh mạch nông không thỏa mãn các tiêu chuẩn về huyết khối đối với APS.
– Bất thường khi mang thai – Một hoặc nhiều ca tử vong không rõ nguyên nhân của một thai nhi bình thường về hình thái khi tuổi thai ≥10 tuần, hoặc một hoặc nhiều ca sinh non của một trẻ sơ sinh bình thường về hình thái trước 34 tuần tuổi thai vì sản giật, tiền sản giật, hoặc thiểu năng nhau thai, hoặc ba hoặc nhiều lần tự phát liên tiếp thai lưu khi tuổi thai <10 tuần, không tìm được nguyên nhân về bất thường nhiễm sắc thể hoặc do nguyên nhân giải phẫu hoặc nội tiết tố của người mẹ.
- Tiêu chí xét nghiệm– Sự hiện diện của một hoặc nhiều kháng thể kháng phospholipid (aPL) sau đây trong hai hoặc nhiều lần cách nhau ít nhất 12 tuần:
– Kháng thể kháng Cardiolipin IgG và / hoặc IgM (aCL) ở hiệu giá trung bình hoặc cao (với hiệu giá > 40 đơn vị) [ 5,16 ].
– Kháng đông Lupus (LA) được phát hiện theo các hướng dẫn đã được công bố [ 3,17,18 ].
Các tiêu chí Sapporo sửa đổi cũng chỉ ra rằng sự hiện diện hoặc không có các yếu tố nguy cơ khác gây huyết khối nên được nhận biết ở các bệnh nhân. Việc phân tầng bệnh nhân như vậy cung cấp thông tin bổ sung có thể hữu ích cho nghiên cứu và điều trị, nhưng không làm thay đổi chẩn đoán.
CHẨN ĐOÁN
Chẩn đoán hội chứng kháng phospholipid (APS) dựa trên sự kết hợp của các đặc điểm lâm sàng và kết quả xét nghiệm. Mặc dù các tiêu chí phân loại được thiết kế cho mục đích nghiên cứu, nhiều bác sĩ lâm sàng cũng để ý tới các tiêu chí này khi đưa ra chẩn đoán APS ở người lớn. Mặc dù các tiêu chí này cũng được chứng minh là đặc hiệu để chẩn đoán APS ở trẻ em, nhưng chúng có thể thiếu nhạy cảm ở nhóm tuổi này [ 19 ]. Chúng tôi mô tả cách tiếp cận chung của chúng tôi để chẩn đoán dưới đây.
Bệnh nhân đáp ứng các tiêu chí phân loại – Chúng tôi chẩn đoán APS ở những bệnh nhân đáp ứng các tiêu chí phân loại Sapporo đã sửa đổi, miễn là không có chẩn đoán khác có thể giải thích các phát hiện lâm sàng [ 12 ]. Như đã đề cập ở trên, tiêu chí Sapporo sửa đổi yêu cầu bệnh nhân đáp ứng ít nhất một tiêu chí lâm sàng liên quan đến huyết khối mạch máu hoặc kết quả thai nghén bất lợi, cũng như sự hiện diện của một hoặc nhiều kháng thể kháng phospholipid (aPL) được chỉ định trong hai hoặc nhiều trường hợp, cách nhau ít nhất 12 tuần. Các tiêu chí Sapporo sửa đổi được coi là hữu ích trong thực hành lâm sàng để tránh “chẩn đoán quá mức” APS.
Bệnh nhân không đáp ứng tiêu chuẩn phân loại – Đôi khi, chúng tôi chẩn đoán APS ở những bệnh nhân không đáp ứng các tiêu chí Sapporo đã sửa đổi. Ví dụ bao gồm những người bị giảm tiểu cầu không rõ nguyên nhân, bệnh van tim, bệnh vi mạch huyết khối thận (bệnh thận aPL), hoặc những người có các biến cố lâm sàng liên quan đến aPL và xét nghiệm aPL giới hạn [ 20 ]. Nên tham khảo ý kiến của bác sĩ lâm sàng có chuyên môn về chẩn đoán APS.
CHẨN ĐOÁN PHÂN BIỆT
Chẩn đoán phân biệt của hội chứng kháng phospholipid (APS) rất rộng và bao gồm các nguyên nhân khác của huyết khối động mạch và tĩnh mạch và sẩy thai tái phát.
Các nguyên nhân khác gây ra huyết khối – Các nguyên nhân khác gây ra huyết khối bao gồm tăng huyết khối do di truyền và mắc phải, tắc nghẽn mạch máu do giải phẫu, đái ra huyết sắc tố kịch phát về đêm (PNH), giảm tiểu cầu do heparin (HIT) và ung thư tăng sinh tủy (MPN). Giống như APS, những tình trạng này có thể liên quan đến huyết khối động mạch hoặc tĩnh mạch, có hoặc không có tế bào máu bất thường. Không giống như APS, những tình trạng này không có bằng chứng về kháng thể kháng phospholipid (aPL) trên xét nghiệm.
Mặt khác, bệnh nhân APS có thể có các yếu tố nguy cơ đồng thời đối với các biến cố huyết khối, bao gồm các yếu tố nguy cơ mắc phải đối với huyết khối tĩnh mạch (ví dụ, bất động, thuốc tránh thai chứa estrogen) cũng như các yếu tố nguy cơ tim mạch.
Các nguyên nhân khác gây sẩy thai nhiều lần – Các nguyên nhân khác gây sẩy thai nhiều lần bao gồm bất thường nhiễm sắc thể, bất thường giải phẫu của tử cung và rối loạn nội tiết như suy giáp. Giống như APS, những người có những bất thường này có thể bị sẩy thai sớm hoặc muộn. Khác với APS, những tình trạng này thường không liên quan đến tăng nguy cơ huyết khối tắc mạch hoặc sự hiện diện của aPL trên xét nghiệm.
Những người không có triệu chứng với aPL
APL thoáng qua – Một số ít người khỏe mạnh có aPL thoáng qua nhưng không có huyết khối lâm sàng hoặc các đặc điểm khác của APS. Ý nghĩa lâm sàng là không rõ ràng, nhưng xét nghiệm theo dõi để đánh giá sự tồn tại của aPL ở những cá nhân này có thể hữu ích. Thông thường là không có triệu chứng lâm sàng. Tuy nhiên, ở một số người, đặc biệt là những người có các yếu tố nguy cơ huyết khối khác, sự hiện diện của aPL có liên quan đến việc tăng nguy cơ phát triển APS. APL trung bình hoặc cao liên tục – Đôi khi các cá nhân được xác định có aPL trung bình hoặc cao dai dẳng (có thể đáp ứng các tiêu chí Sapporo đã sửa đổi về mặt xét nghiệm) nhưng không có biểu hiện lâm sàng của APS. Hai tình huống phổ biến nhất trong đó xảy ra là bệnh nhân SLE được sàng lọc aPL thường xuyên và bệnh nhân được sàng lọc đông máu cho một chỉ định không liên quan được phát hiện có chất kháng đông lupus (LA). Trong khi những bệnh nhân này không có APS, họ có nguy cơ mắc các biểu hiện lâm sàng của APS như đã nêu ở trên. Có lý khi cho rằng tất cả bệnh nhân mắc APS, trong một khoảng thời gian trước đây, là những người không có triệu chứng với mức aPL đáng kể. Mức độ rủi ro và vai trò của điều trị dự phòng ở những bệnh nhân này còn đang tranh cãi.
Các tình trạng khác liên quan đến aPL – Ngoài sự xuất hiện của chúng trong APS chính, aPL có thể xuất hiện ở một số người khỏe mạnh, mắc bệnh tự miễn dịch hoặc bệnh thấp khớp và đã tiếp xúc với một số loại thuốc hoặc tác nhân lây nhiễm. Sự hiện diện của aPL đơn độc, trong trường hợp không có biến cố huyết khối hoặc bất thường khi mang thai, không đủ để chẩn đoán APS. Việc đánh giá một bệnh nhân có aPL dương tính đối với những tình trạng này phụ thuộc vào biểu hiện và tình trạng lâm sàng.
Các bệnh tự miễn – Bệnh tự miễn thường gặp nhất liên quan đến aPL là bệnh lupus ban đỏ hệ thống (SLE). Một hồ sơ aPL có ý nghĩa lâm sàng đã được phát hiện ở khoảng 30% bệnh nhân mắc SLE [ 21 ]:
- Khoảng 31% bệnh nhân có LA [ 22]
- 23 đến 47% có kháng thể kháng Cardiolipin (aCL) [ 6,22,23]
- 20% có kháng thể với beta2-glycoprotein (GP) I [ 6]
Ngược lại, trong một nhóm thuần tập gồm 1000 bệnh nhân APS, APS có liên quan đến SLE ở 36% bệnh nhân và với hội chứng giống lupus ở thêm 5% [ 11 ].
Cả LAs và aCL cũng đã được tìm thấy ở những bệnh nhân mắc nhiều bệnh tự miễn và bệnh thấp khớp khác (ví dụ, xơ cứng bì, viêm khớp vảy nến) nhưng, trong trường hợp không có các biến cố lâm sàng liên quan đến APS, ý nghĩa của chúng không rõ ràng [ 24,25 ] .
Nhiễm trùng – aPL cũng đã được ghi nhận ở những bệnh nhân bị nhiễm trùng. Đây thường là IgM aCL, hiếm khi gây ra các biến cố huyết khối [ 24,26 ]. Hơn nữa, các kháng thể này thường không có hoạt tính kháng thể kháng beta2-GP I [ 27,28 ]. Các bệnh nhiễm trùng có liên quan đến aPLs bao gồm [ 25,27-35 ]:
- Nhiễm trùng do vi khuẩn – Nhiễm trùng huyết do vi khuẩn, bệnh leptospirosis, bệnh giang mai, bệnh Lyme (borreliosis), bệnh lao, bệnh phong, viêm nội tâm mạc nhiễm trùng, sốt thấp khớp sau liên cầu và nhiễm trùng Klebsiella.
- Nhiễm vi-rút – Viêm gan A, B và C, quai bị, vi-rút suy giảm miễn dịch ở người (HIV), vi-rút HTLV-I, cytomegalovirus, varicella-zoster, vi-rút Epstein-Barr (EBV), adenovirus parvovirus, và rubella. Một số nghiên cứu trước đó đã báo cáo mối liên quan giữa nhiễm vi rút viêm gan C (HCV) và aPL [ 30-32]. Tuy nhiên, các nghiên cứu tiếp theo cho thấy không có mối liên hệ nào giữa hai rối loạn [ 33]. Do đó, mối tương quan giữa nhiễm HCV và aPL, nếu có, là yếu và có thể không có ý nghĩa gây bệnh.
- Nhiễm ký sinh trùng – Sốt rét, Pneumocystis jirovecii, và bệnh leishmaniasis nội tạng (còn được gọi là kala-azar).
- Thuốc– Một số loại thuốc có liên quan đến aPL. Chúng bao gồm phenothiazines (chlorpromazine), phenytoin , hydralazine , procainamide , quinidine , quinine , ethosuximide , alpha interferon, amoxicillin , chlorothiazide , thuốc tránh thai và propranolol [ 25,26,36,37 ]. Các aPL thường thoáng qua, thường là dạng IgM, và hiếm khi liên quan đến huyết khối. Cơ chế của aPL do thuốc chưa được biết.
- Bệnh ác tính– Các báo cáo về aPL trong các bệnh lý ác tính bao gồm các khối u rắn ở phổi, ruột kết, cổ tử cung, tuyến tiền liệt, thận, buồng trứng, vú và xương; Bệnh Hodgkin và u lympho không Hodgkin; MPN (ví dụ, bệnh xơ tủy nguyên phát, bệnh đa hồng cầu); và bệnh bạch cầu dòng tủy và lympho bào [ 25,38].
TÀI LIỆU THAM KHẢO
- Lim W. Antiphospholipid syndrome. Hematology Am Soc Hematol Educ Program 2013; 2013:675.
- Khamashta MA, Amigo MC. Antiphospholipid syndorme: overview of pathogenesis, diagnosis, and management. In: Rheumatology, 6, Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH (Eds), Elsevier, Philadelphia 2015. Vol 2, p.1144.
- Pengo V, Tripodi A, Reber G, et al. Update of the guidelines for lupus anticoagulant detection. Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost 2009; 7:1737.
- Ruiz-Irastorza G, Crowther M, Branch W, Khamashta MA. Antiphospholipid syndrome. Lancet 2010; 376:1498.
- Giannakopoulos B, Passam F, Ioannou Y, Krilis SA. How we diagnose the antiphospholipid syndrome. Blood 2009; 113:985.
- Sebastiani GD, Galeazzi M, Tincani A, et al. Anticardiolipin and anti-beta2GPI antibodies in a large series of European patients with systemic lupus erythematosus. Prevalence and clinical associations. European Concerted Action on the Immunogenetics of SLE. Scand J Rheumatol 1999; 28:344.
- Bertolaccini ML, Amengual O, Andreoli L, et al. 14th International Congress on Antiphospholipid Antibodies Task Force. Report on antiphospholipid syndrome laboratory diagnostics and trends. Autoimmun Rev 2014; 13:917.
- Bertolaccini ML, Amengual O, Artim-Eser B, et al. Clinical and prognostic significance of non-criteria antiphospholipid antibody tests. In: Antiphospholipid Syndrome: Current Research Highlights and Clinical Insights, Erkan D, Lockshin MD (Eds), Springer International Publishing, 2017. p.171.
- Petri M, Orbai AM, Alarcón GS, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64:2677.
- Vila P, Hernández MC, López-Fernández MF, Batlle J. Prevalence, follow-up and clinical significance of the anticardiolipin antibodies in normal subjects. Thromb Haemost 1994; 72:209.
- Cervera R, Piette JC, Font J, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum 2002; 46:1019.
- Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006; 4:295.
- Wilson WA, Gharavi AE, Koike T, et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum 1999; 42:1309.
- Kaul M, Erkan D, Sammaritano L, Lockshin MD. Assessment of the 2006 revised antiphospholipid syndrome classification criteria. Ann Rheum Dis 2007; 66:927.
- Bobba RS, Johnson SR, Davis AM. A review of the sapporo and revised Sapporo criteria for the classification of antiphospholipid syndrome. Where do the revised sapporo criteria add value? J Rheumatol 2007; 34:1522.
- Reber G, Tincani A, Sanmarco M, et al. Proposals for the measurement of anti-beta2-glycoprotein I antibodies. Standardization group of the European Forum on Antiphospholipid Antibodies. J Thromb Haemost 2004; 2:1860.
- Clinical and Laboratory Standards Institute (CLSI). Laboratory Testing for the Lupus Anticoagulant; Approved Guideline. CLSI document H60-A. Wayne, PA. Clinical and Laboratory Standards Institute, 2014.
- http://shop.clsi.org/c.1253739/site/Sample_pdf/H60A_sample.pdf (Accessed on February 17, 2016).
- Groot N, de Graeff N, Avcin T, et al. European evidence-based recommendations for diagnosis and treatment of paediatric antiphospholipid syndrome: the SHARE initiative. Ann Rheum Dis 2017; 76:1637.
- Abreu MM, Danowski A, Wahl DG, et al. The relevance of “non-criteria” clinical manifestations of antiphospholipid syndrome: 14th International Congress on Antiphospholipid Antibodies Technical Task Force Report on Antiphospholipid Syndrome Clinical Features. Autoimmun Rev 2015; 14:401.
- Taraborelli M, Leuenberger L, Lazzaroni MG, et al. The contribution of antiphospholipid antibodies to organ damage in systemic lupus erythematosus. Lupus 2016; 25:1365.
- Love PE, Santoro SA. Antiphospholipid antibodies: anticardiolipin and the lupus anticoagulant in systemic lupus erythematosus (SLE) and in non-SLE disorders. Prevalence and clinical significance. Ann Intern Med 1990; 112:682.
- Abu-Shakra M, Gladman DD, Urowitz MB, Farewell V. Anticardiolipin antibodies in systemic lupus erythematosus: clinical and laboratory correlations. Am J Med 1995; 99:624.
- McNeil HP, Chesterman CN, Krilis SA. Immunology and clinical importance of antiphospholipid antibodies. Adv Immunol 1991; 49:193.
- Cervera R, Asherson RA. Clinical and epidemiological aspects in the antiphospholipid syndrome. Immunobiology 2003; 207:5.
- Triplett DA. Many faces of lupus anticoagulants. Lupus 1998; 7 Suppl 2:S18.
- McNally T, Purdy G, Mackie IJ, et al. The use of an anti-beta 2-glycoprotein-I assay for discrimination between anticardiolipin antibodies associated with infection and increased risk of thrombosis. Br J Haematol 1995; 91:471.
- Santiago M, Martinelli R, Ko A, et al. Anti-beta2 glycoprotein I and anticardiolipin antibodies in leptospirosis, syphilis and Kala-azar. Clin Exp Rheumatol 2001; 19:425.
- García Moncó JC, Wheeler CM, Benach JL, et al. Reactivity of neuroborreliosis patients (Lyme disease) to cardiolipin and gangliosides. J Neurol Sci 1993; 117:206.
- Prieto J, Yuste JR, Beloqui O, et al. Anticardiolipin antibodies in chronic hepatitis C: implication of hepatitis C virus as the cause of the antiphospholipid syndrome. Hepatology 1996; 23:199.
- Matsuda J, Saitoh N, Gotoh M, et al. High prevalence of anti-phospholipid antibodies and anti-thyroglobulin antibody in patients with hepatitis C virus infection treated with interferon-alpha. Am J Gastroenterol 1995; 90:1138.
- Leroy V, Arvieux J, Jacob MC, et al. Prevalence and significance of anticardiolipin, anti-beta2 glycoprotein I and anti-prothrombin antibodies in chronic hepatitis C. Br J Haematol 1998; 101:468.
- Muñoz-Rodríguez FJ, Tàssies D, Font J, et al. Prevalence of hepatitis C virus infection in patients with antiphospholipid syndrome. J Hepatol 1999; 30:770.
- Uthman IW, Gharavi AE. Viral infections and antiphospholipid antibodies. Semin Arthritis Rheum 2002; 31:256.
- Von Landenberg P, Lehmann HW, Knöll A, et al. Antiphospholipid antibodies in pediatric and adult patients with rheumatic disease are associated with parvovirus B19 infection. Arthritis Rheum 2003; 48:1939.
- Merrill JT, Shen C, Gugnani M, et al. High prevalence of antiphospholipid antibodies in patients taking procainamide. J Rheumatol 1997; 24:1083.
- Dlott JS, Roubey RA. Drug-induced lupus anticoagulants and antiphospholipid antibodies. Curr Rheumatol Rep 2012; 14:71.
- Vassalo J, Spector N, de Meis E, et al. Antiphospholipid antibodies in critically ill patients with cancer: a prospective cohort study. J Crit Care 2014; 29:533.
Để lại một phản hồi