Nội dung chính
- 1 Tóm tắt
- 2 Thuốc kháng đông
- 2.1 Phân tầng nguy cơ
- 2.2 Cơ chế hình thành huyết khối
- 2.3 Tiểu nhĩ trái
- 2.4 Tái cấu trúc
- 2.5 Đích đến của cục huyết khối
- 2.6 Rung nhĩ vĩnh viễn
- 2.7 INR tối ưu là bao nhiêu?
- 2.8 Tuân thủ dùng kháng vitamin K
- 2.9 Vai trò của thuốc kháng kết tập tiểu cầu
- 2.10 Kết hợp thuốc
- 2.11 Nghiên cứu thuốc
- 2.12 Rung nhĩ kịch phát
- 2.13 Cuồng nhĩ
- 2.14 Sốc điện chuyển nhịp
- 2.15 Các phương pháp kháng đông không dùng thuốc
- 2.16 Kiểm soát nhịp và tần số tim
- 3 Chuyển nhịp xoang
- 4 Dự phòng tái phát
- 5 Kiểm soát tần số thất
- 5.1 Tiêu chuẩn
- 5.2 Thuốc Digoxin
- 5.3 Thuốc đối kháng Canxi
- 5.4 Các thuốc chẹn beta
- 5.5 Các thuốc khác
- 5.6 Đặt máy tạo nhịp và khử rung tim
- 5.7 Tạo nhịp để hỗ trọ tần số: VVIR và DDDR
- 5.8 Đặt máy nhiều vị trí hoặc vị trí thay thế
- 5.9 Sơ đồ dự phòng/đặt máy chống loạn nhịp nhanh
- 5.10 Máy khử rung nhĩ (ghép máy chuyển nhịp và máy khử rung)
- 5.11 Điều trị phối hợp (Hybrid)
- 6 Đốt điện qua catheter/sửa đổi nút nhĩ thát để kiểm soát tần số tim
- 7 Cắt đốt rung nhĩ
- 8 Tổng kết
- 9 References
Bài viết Những điều cần biết về điều trị rung nhĩ – Tải file PDF Tại đây.
Biên dịch: Bs Hoàng Nam
Tóm tắt
Các mục tiêu chính của điều trị rung nhĩ (AF) là giảm triệu chứng, dự phòng thuyên tắc do huyết khối, dự phòng tỷ lệ mắc và ngăn ngừa tỷ lệ tử vong. Có 3 cách tiếp cận nền tảng điều trị rung nhĩ: kiểm soát tần số tim, kiểm soát nhịp tim và điều trị thuốc chống huyết khối (kháng đông).
Các lợi ích tiềm năng của chiến lược kiểm soát nhịp tim là nâng cao kiểm soát triệu chứng, thiếu các thuốc chống loạn nhịp (AA) với các tác dụng phụ nghiêm trọng, chế độ dùng thuốc đơn giản và ít tốn kém hơn. Tuy nhiên, những bất lợi của chiến lược này gồm ảnh hưởng huyết động, tái cấu trúc tâm nhĩ và nguy cơ dùng kháng đông lâu dài.
Mặc khác, duy trì nhịp xoang lâu dài vẫn là thách thức lớn trong lĩnh vực này. Đến nay chưa có thuốc điều trị rung nhĩ hiệu quả và an toàn được quản lý với sự tự tin cho phạm vi rộng bệnh nhân. Thậm chí điều trị tối ưu, điều trị bằng thuốc hiếm khi “chữa hết bệnh”, trên thực tế rõ ràng chúng ta cần các thuốc điều trị rung nhĩ tốt hơn ít sự tham gia của tim và gây độc cơ quan.
Warfarin có hiệu quả giảm đáng kể tỷ lệ biến cố thuyên tắc do huyết khối trên bệnh nhân rung nhĩ do bệnh van tim hay rung nhĩ không do bệnh van tim, nhưng có các biến chứng của riêng warfarin. Các thuốc kháng đông mới có sự chấp thuận tốt hơn và các kỹ thuật không dùng thuốc để loại bỏ tiểu nhĩ trái (LAA) hiện nay đang được đánh giá trên lâm sàng.
Hiện nay, có nhiều cách tiếp cận không dùng thuốc để điều trị rung nhĩ dai dẳng, đặt máy lâu dài, phẫu thuật, cắt đốt qua catheter, đã được thông qua từ những năm 1990 và vẫn đang phát triển nhanh chóng. Dựa vào ngắt liên kết tĩnh mạch phổi hoặc thay đổi cơ thất, phá rung nhĩ qua catheter có tác động tích cực và đáng kể lên chất lượng cuộc sống trên bệnh nhân và hiện nay được thực hiện hàng ngày trong các phòng thí nghiệm sinh lý điện.
Cuối cùng, chúng ta phải ghi nhớ là không chỉ có 1 mà là có nhiều loại rung nhĩ và phải cá nhân hóa điều trị dựa trên từng loại rung nhĩ và đặc điểm lâm sàng trên từng bệnh nhân.
Thuốc kháng đông
Nguy cơ thuyên tắc động mạch do rung nhĩ đã được công nhận từ lâu. Nhiều nghiên cứu độc lập, được thực hiện trước thời gian thuốc kháng đông được khuyến cáo dùng trên những bệnh nhân rung nhĩ, đã xác nhận mối liên quan tăng nguy cơ 2.3-6.9 trên bệnh nhân rung nhĩ không có triệu chứng thực thể bệnh thấp van 2 lá (hay còn gọi là rung nhĩ không do bệnh van tim) so với các nhóm chứng không rối loạn nhịp tim [1]. Nguy cơ thuyên tắc càng gia tăng khi rung nhĩ là hậu quả của bệnh thấp van 2 lá, ước tính gấp 17 lần nguy cơ tương ứng của một người khỏe mạnh [2].
Phân tầng nguy cơ
Tỷ lệ thuyên tắc trong rung nhĩ không do bệnh van tim phụ thuộc tuổi của bệnh nhân và có hay không các triệu chứng bệnh tim mạch [3]. Bệnh nhân rung nhĩ không do bệnh van tim 60 tuổi và không có tiền sử bệnh tim hoặc chưa có bằng chứng trên siêu âm tim sẽ có nguy cơ đột quỵ rất thấp, ước tính khoảng 1.3% sau 15 năm [4]. Ngược lại, nguy cơ cao nhất đột quỵ trên bệnh cảnh rung nhĩ không do bệnh van tim được xác định trên những bệnh nhân đã từng đột quỵ hoặc từng bị đợt cấp cơn thiếu máu cục bộ thoáng qua [3].
Bảng 30.1 Các mức nguy cơ đột quy do thiếu máu cục bộ và thuyên tắc hệ thống trên bệnh nhân rung nhĩ.
| Yếu tố nguy cơ | Mức nguy cơ |
| Bệnh thấp tim | Rất cao |
| Bệnh cơ tim phì đại | Rất cao |
| Bệnh nút xoang nhĩ | Có lẽ rất cao |
| Tiền sử đột quy hoặc cơn thiếu máu cục bộ thoáng qua | Cao |
| Tiền sử tăng huyết áp | Cao |
| Suy tim sung huyết | Cao |
| Tuổi > 65 | Cao |
| Đái tháo đường | Cao |
| Bệnh động mạch vành | Cao |
| Cường giáp | Khá cao |
| Tuổi < 65, không có bệnh kèm theo | Thấp |
Bảng 30.1 cho thấy các nguy cơ liên quan đột quỵ hoặc thuyên tắc hệ thống trên bệnh nhân rung nhĩ không do bệnh van tim và các yếu tố nguy cơ khác. Tuy nhiên, không có yếu tố nào trong số các yếu tố nguy cơ ở trên đạt đến mức nguy cơ quan sát thấy trong rung nhĩ do bệnh van 2 lá.
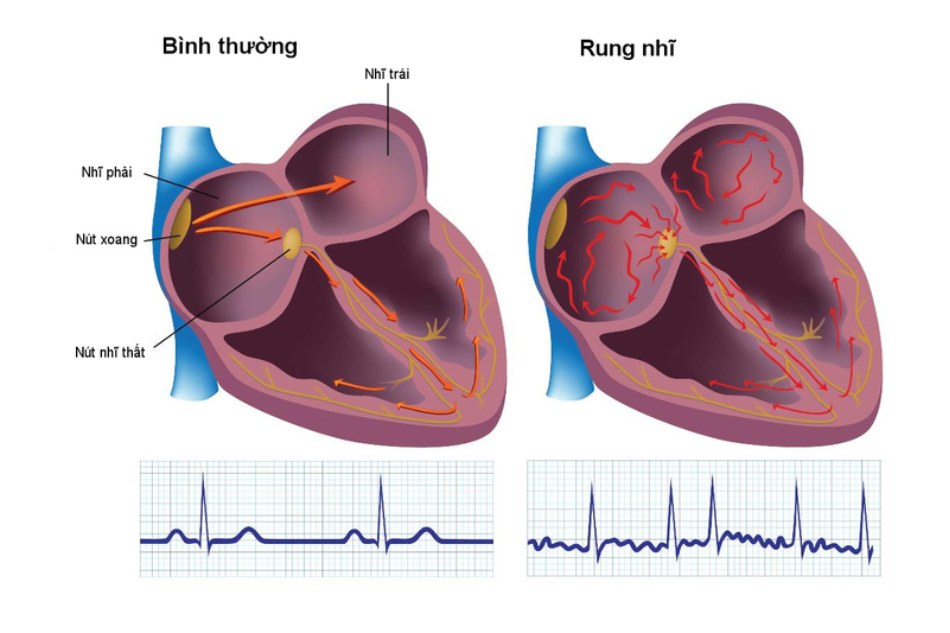
Cơ chế hình thành huyết khối
Nguy cơ đột quỵ hoặc thuyên tắc hệ thống tăng rõ rệt trên bệnh nhân rung nhĩ không do bệnh van tim có liên quan 2 tình trạng bất lợi rõ ràng: sự tồn tại của một phần “ngõ cụt” trong hệ tuần hoàn, gọi là tiểu nhĩ trái (LAA), cùng với giảm đáng kể chức năng cơ học cơ tâm nhĩ do rối loạn nhịp tim. Thật vậy, LAA là nguồn gốc thuyên tắc chính trên những bệnh nhân này [5]. Do đó, theo một đánh giá từ 23 nghiên cứu khác nhau tìm kiếm nguồn gốc thuyên tắc động mạch trên bệnh nhân rung nhĩ, người ta kết luận tiểu nhĩ trái là nguồn thuyên tắc chiếm 91% bệnh nhân rung nhĩ không do bệnh van tim. Ngược lại, tầm quan trọng của LAA như một nguồn thuyên tắc lại thấp hơn ở bệnh nhân bệnh thấp van 2 lá và rung nhĩ, chiếm 57%. Ngoài cấu trúc giải phẫu không thuận lợi và hiệu suất LAA cơ học bị suy giảm, rối loạn chức năng nội tâm mạc cũng như hệ thống kháng đông cũng có vai trò hình thành cục máu đông [6].
Tiểu nhĩ trái
Tiểu nhĩ trái (LAA) chỉ là một phần trong hệ tuần hoàn không có dòng máu chảy qua. Thay vào đó, nó là một túi không nhìn thấy, chiếm không gian 3 chiều trong túi màng ngoài tim hình trứng xung quanh và được tạo thành bởi đường viền tròn của cơ tâm thất trái, thân tâm nhĩ và đường thoát của thất phải. Bên trong, nó được phân thành các bè rõ rệt, có thể hình dung bằng các trụ của khoang tim trái (hình 30.1). Sự hình thành LAA thay đổi rõ rệt trên từng người. Thể tích tiểu nhĩ trái được đo bằng kỹ thuật đánh giá trụ trong một nghiên cứu tử thi và nằm trong khoảng 0.7-19.2 ml [8]. Nghiên cứu này cũng ghi nhận thay đổi kích thước rõ rệt của lỗ LAA (5-27mm) và đường kính lớn nhất (10-40mm). Thú vị là LAA trên những người bị rung nhĩ suốt đời có đường kính lớn hơn so với những người không có rối loạn nhịp tim.
Sẽ là không phù hợp nếu chỉ xem LAA là cấu trúc thụ động, lấp đầy khoảng trống trong túi ngoại tâm mạc.
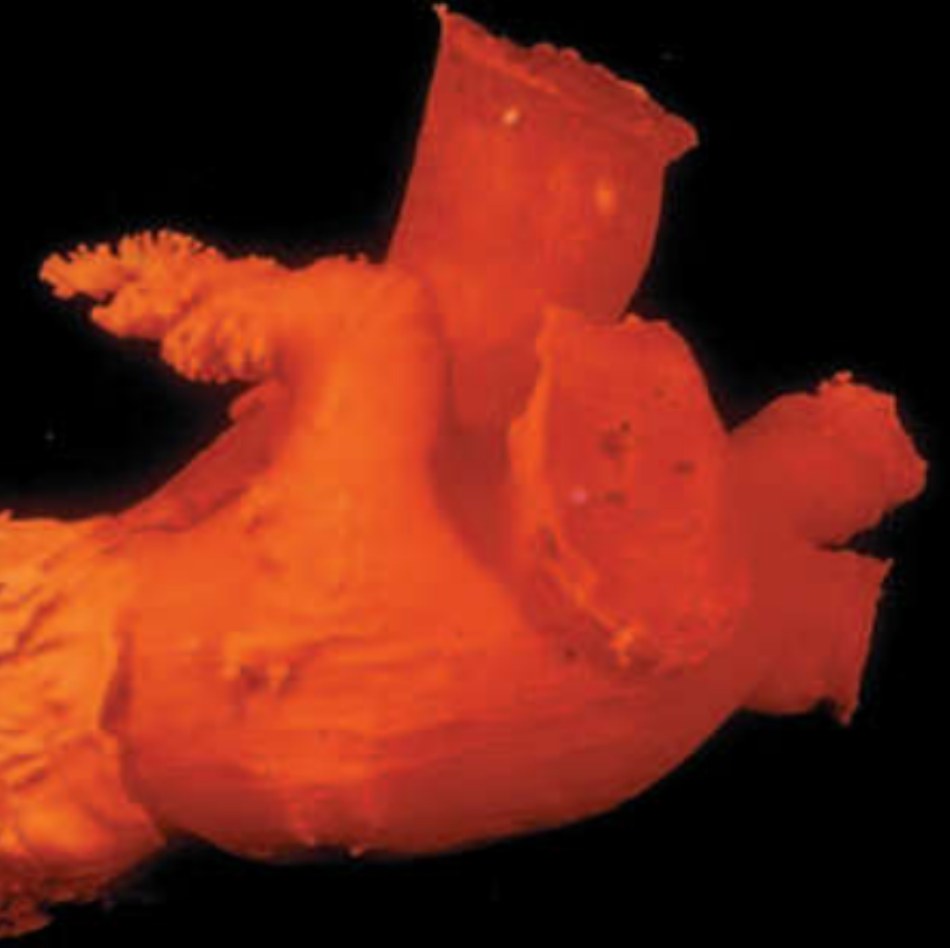
Đây là nguồn huyết khối trong nhĩ trái trên bệnh nhân rung nhĩ không do bệnh van tim (Courtesy of Dr Yen Ho.)
Thành tiểu nhĩ trái chứa nồng độ lớn yéu tố bài niệu natri tâm nhĩ và được cung cấp bởi nhiều dây thần kinh và thụ thể [9], phản ánh vai trò của LAA trong sinh lý điều hòa lưu lượng máu.
Tái cấu trúc
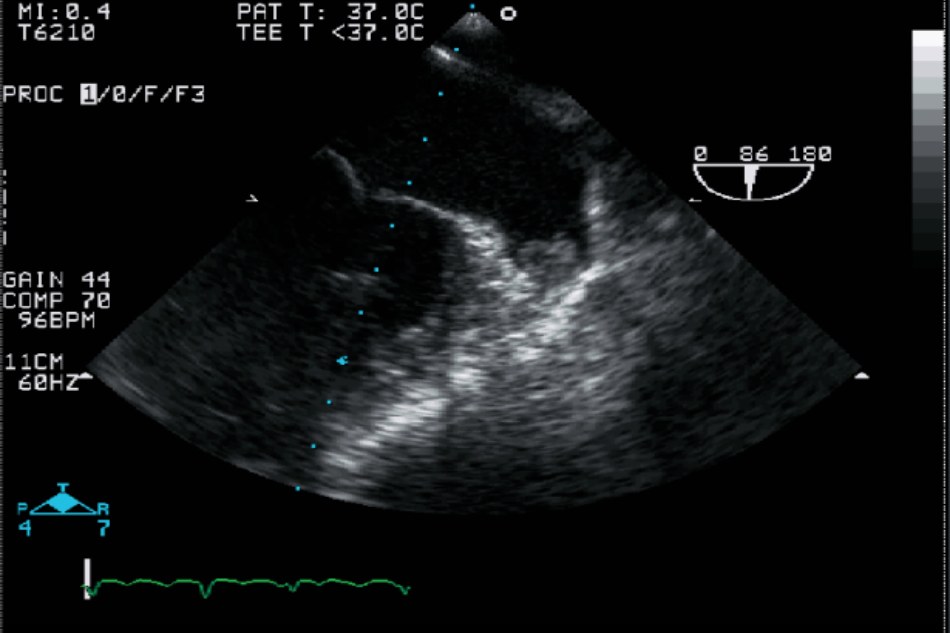
Sau khi bắt đầu rung nhĩ, cơ tim trong vài ngày đén vài tuần trải qua quá trình tái cấu trúc cả về hoạt động điện lẫn cơ học, két quả là sau đó tăng tần số tim cũng như giảm khả năng co bóp [10]. Tái cấu trúc cơ tim sau đó sẽ tiếp tục rối loạn nhip trong 1 thời gian dài [11], làm suy giảm chức năng của LAA. Có thể xác định diễn tiến không thuận lợi này bằng cách siêu âm tim qua ngả thực quản (TOE), cho thấy tốc độ dòng chảy LAA giảm rõ rệt. Tốc độ dòng chảy tử LAA càng giảm, nguy cơ dẫn đén hình thành huyết khối càng gia tăng trong khoang [12]. Hình 30.2 mô tả hình ảnh tử TOE của LAA chứa cục máu đông.
Đích đến của cục huyết khối
Thuyên tắc bắt nguồn từ rung nhĩ trái có thể theo dòng máu đến bất kỳ phần nào trong cơ thể. Tuy nhiên, mối liên hệ giữa tỷ lệ đột quỵ và bằng chứng thuyên tắc hệ thống trên lâm sàng trong rung nhĩ không do bệnh van tim khác biệt rõ rệt so với tỷ lệ máu chảy đến não và phần còn lại của cơ thể. Do đó, tỷ lệ đột quỵ cao hơn 10 lần so với tỷ lệ thuyên tắc hệ thống trên bệnh nhân rung nhĩ không do bệnh van tim mà không uống bất kỳ thuốc kháng huyết khối nào [13]. Sự khác biệt này có thể được giải thích một phần do thực té là thuyên tắc “âm thầm” có khả năng phổ biến hơn trong tuần hoàn hệ thống, mặc dù cũng có thể xảy ra trong các mạch máu não [14].
Rung nhĩ vĩnh viễn
Vitamin K là một yéu tố cần thiết trong một vài bước của chuỗi đông máu. Can thiệp vào quá trình đông máu bằng cách sử dụng chất đối vận vitamin K (VKA) đã là 1 nội dung điều trị trong hơn nửa thé kỷ. Mục tiêu của điều trị này là dự phòng sự hình thành thuyên tắc do huyết khối mà không ảnh hưởng đén quá trình đông máu đén mức gây chảy máu không kiểm soát vượt trội hơn so với tác dụng có lợi.
Lợi ích của liệu pháp dự phòng kháng vitamin K trong rung nhĩ không do bệnh van tim đã được nghiên cứu trong một số thử nghiệm ngẫu nhiên có đối chứng. Thử nghiệm đầu tiên được công bố là Danish AFASAK, chứng minh giảm 54% nguy cơ đột quỵ liên quan điều trị kháng vitamin K [15]. Kể từ đó, các nghiên cứu ngẫu nhiên có đối chứng thiếu máu cục bộ mà còn tất cả loại đột quỵ do xuất huyết, có thể do điều trị kháng vitamin K gây ra. Số ca xuất huyết nội sọ nhiều gấp đôi trong nhóm nghiên cứu dùng kháng vitamin K so với nhóm nghiên cứu dùng giả dược, mặc dù khác biệt không có ý nghĩa thống kê (6 so với 3 ca). Hơn thế nữa, điều trị kháng vitamin K liên quan tăng nguy cơ chảy máu ngoài sọ nặng, tương ứng với mức nguy cơ chắc chắn là 0.3% [16].
khác cũng được công bố nhận thấy vai trò của kháng vitamin K trong dự phòng đột quỵ đối với rung nhĩ không do bệnh van tim, tổng cộng so sánh lợi ích của điều trị kháng vitamin K trên 1450 bệnh nhân rung nhĩ dùng giả dược trong một nhóm bệnh nhân kích cỡ tương tự. Khi gộp lại với nhau thành 1 phân tích tổng hợp (hình 30.3), giảm nguy cơ tương đối cao hơn đáng kể và chiếm 62%, tương ứng với giảm nguy cơ tuyệt đối hàng năm là 2.7% [16]. Đáng chú ý, đây là giảm nguy cơ trên bệnh nhân “dự định” uống thuốc kháng đông. Giảm nguy cơ tương đối trên bệnh nhân thật sự dùng thuốc kháng đông rất cao ở mức 85% [17].
Tỷ lệ đột quỵ ở trên không chỉ bao gồm đột quỵ do thiếu máu cục bộ mà còn tất cả loại đột quỵ do xuất huyết, có thể do điều trị kháng vitamin K gây ra. Số ca xuất huyết nội sọ nhiều gấp đôi trong nhóm nghiên cứu dùng kháng vitamin K so với nhóm nghiên cứu dùng giả dược, mặc dù khác biệt không có ý nghĩa thống kê (6 so với 3 ca). Hơn thế nữa, điều trị kháng vitamin K liên quan tăng nguy cơ chảy máu ngoài sọ nặng, tương ứng với mức nguy cơ chắc chắn là 0.3% [16].
Điều quan trọng là ở những nghiên cứu này đã loại trừ bệnh nhân có nguy cơ thuyên tắc thấp hoặc nguy cơ xuất huyết tăng rõ rệt cũng như nguy cơ tắc mạch cao nhất. Trong chiến lược gần đây, trong đó khuyến cáo điều trị kháng vitamin K (mặc dù lợi ích không được mô tả trong các thử nghiệm lâm sàng ngẫu nhiên), bao gồm bệnh nhân rung nhĩ có van tim nhân tạo hoặc mắc bệnh thấp van 2 lá hoặc bệnh cơ tim phì đại. Ngoài ra, rung nhĩ trong bệnh cường giáp thường được xếp trong nhóm này.
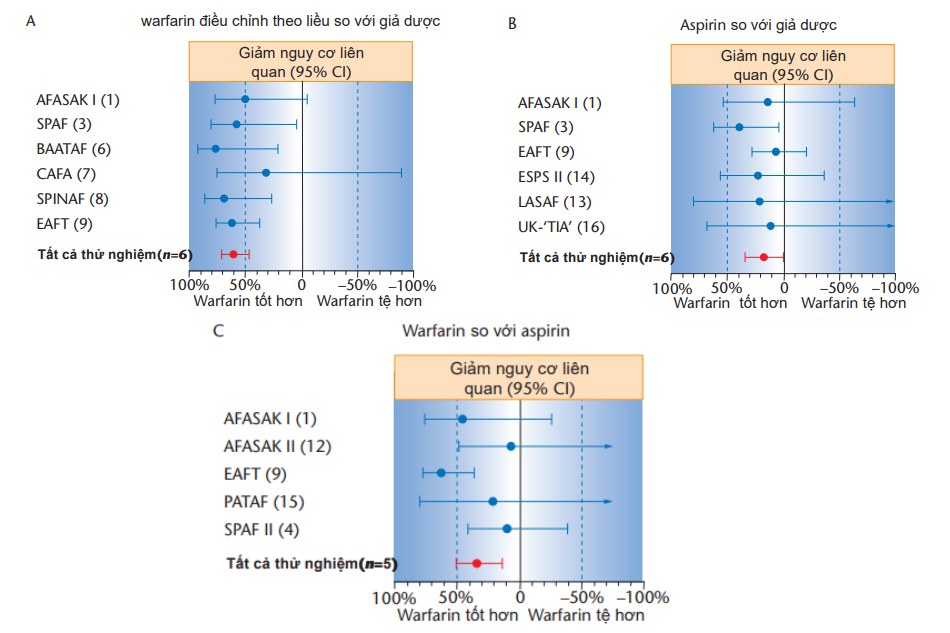
Hình 3 Tác dụng trên tất cả loại đột quy (thiếu máu cục bộ và xuất huyết) điều trị bệnh nhân rung nhĩ
(A) warfarin điều chỉnh theo liều so với giả dược (6 thử nghiệm ngẫu nhiên); (B) aspirin so với giả dược (6 thử nghiệm ngẫu nhiên); (C) warfarin điều chỉnh theo liều so với aspirin (5 thử nghiệm ngẫu nhiên). Đường nằm ngang là 95% khoảng tin cậy xung quanh điểm ước lượng. Nghiên cứu AFASAK, Rung nhĩ Copenhagen, Aspirin và kháng đông; BAATAF, Thử nghiệm kháng đông đối với rung nhĩ ở vùng Boston; CAFA, Nghiên cứu kháng đông rung nhĩ Canada; EAFT, Thử nghiệm rung nhĩ châu Âu; ESPS II, Nghiên cứu dự phòng đột quy châu Âu II; LASAF, Aspirin liều thấp, Nghiên cứu sơ bộ rung nhĩ và đột quy; PATAF, Dự phòng thuyên tắc động mạch do huyết khối trong rung nhĩ; SPAF, Nghiên cứu dự phòng đột quy trong rung nhĩ; SPINAF, Dự phòng đột quy trong rung nhĩ không do bệnh thấp; UK-TIA, Nghiên cứu cơn thiếu máu não thoáng qua TIA tại Anh. Sao chép dưới sự cho phép của Hart và cộng sự [16].
Được hỗ trợ từ các kết quả trích dẫn trong các thử nghiệm ở trên, điều trị kháng vitamin K được khuyến cáo mạnh mẽ trên bệnh nhân rung nhĩ có thêm các chỉ số nguy cư đôt quỵ, miễn là không có chống chỉ định [18].
INR tối ưu là bao nhiêu?
Tác động kháng đông của một liều kháng vitamin K cố định mang tính cá nhân cao và bị ảnh hưởng rõ rệt do sự tương tác những thành phần trong thức ăn và số lượng lớn thuốc. Do đó, mức độ kháng đông với mỗi bệnh nhân nhất định phải được đo lường tác dụng sinh học. Hiện nay, mức kháng đông trong mẫu huyết thanh được biểu thị bằng tỷ lệ chuẩn hóa quốc tế (INR) – là tỷ lệ giữa thời gian Prothromin thực tế và thời gian prothromin của huyết thanh chuẩn hóa có đối chứng. Mặc dù nhiều tranh cải xoay quanh tính chính xác của kỹ thuật so sánh này [19], nhưng INR đã được chấp thuận rộng rãi.
Các nghiên cứu ngẫu nhiên có đối chứng chứng minh lợi ích của điều trị kháng vitamin K trên bệnh nhân rung nhĩ không do bệnh van tim không được sử dụng với kháng đông tương ứng, cũng như không sử dụng xét nghiệm đông máu tương ứng [16]. Cố gắng tính lại các mức mục tiêu khác nhau với giá trị INR cho thấy giá trị biến thiên trong khoảng từ 1.4 – 4.5 trong các nghiên cứu này. Thông tin hữu ích khác quyết định giới hạn trên và dưới của INR lí tưởng để dự phòng đột quỵ tối ưu [21] và tránh đột quỵ do xuất huyết liên quan kháng vitamin K [21] đã đạt được bằng cách nghiên cứu sự xuất hiện của các biến cố tương ứng liên quan mức độ INR.
Dựa vào tổng hợp các thông tin, đã đạt đồng thuận INR 2.0-3.0 có thể là giá trị lý tưởng dự phòng đột quỵ và thuyên tắc hệ thống trên bệnh nhân rung nhĩ không do bệnh van tim. Một phân tích nguy cơ tử vong trong quần thể điều trị kháng vitamin K gồm hơn 40.000 bệnh nhân gợi ý cửa sổ INR nên hẹp hơn, giá trị cần đạt nên gần mức 2.2-2.3 [22]. Hình 30.4 mô tả nguy cơ đột quỵ do thiếu máu cục bộ và chảy máu nội sọ liên quan INR cũng như nguy cơ tử vong trong 1 tháng liên quan INR trên bệnh nhân rung nhĩ.
![(A) Tỷ lệ odds điều chỉnh đối với đột quỵ do thiếu máu cục bộ và chảy máu nội sọ liên quan tỷ lệ chuẩn hóa quốc tế (INR). Được sao chép với sự cho phép của Fuster cùng cộng sự [18]. (B) Nguy cơ tử vong trong tháng sau xét ngiệm INR liên quan giá trị INR.](https://songkhoemoingay.com/wp-content/uploads/2023/04/Hinh-4.jpg)
Được sao chép với sự cho phép của Fuster cùng cộng sự [18]. (B) Nguy cơ tử vong trong tháng sau xét ngiệm INR liên quan giá trị INR.
Tuân thủ dùng kháng vitamin K
Bởi vì điều trị kháng vitamin K tối ưu phụ thuộc hoàn toàn vào sự duy trì mức độ kháng đông trong giới hạn INR mục tiêu, các xét nghiệm máu để định lượng INR nên làm thường xuyên và phải điều chỉnh liều kháng vitamin K nếu cần. Trên lâm sàng thường quy, mức INR đã thử không bao giờ đạt được hoàn toàn.
Trong quá trình theo dõi gần 13.000 bệnh nhân-năm có dùng warfarin, mức INR dưới 2.0 chiếm 26.8%, từ 2.0-3.0 chiếm 62.5% và trên 3.0 chiếm 10.7% [23]. Rõ ràng là liều thuốc bị ảnh hưởng nhiều hơn bởi nguy cơ xuất huyết có thể do điều trị dùng quá liều hơn là nguy cơ thuyên tắc do huyết khối vì dùng không đủ liều. Mặc dù thời gian giới hạn trong khoảng INR dự định có thể làm thất vọng, các thời gian tương tự trong các nghiên cứu lâm sàng cở mẫu lớn có đối chứng chứng minh là dùng liều thấp hay quá liều đều rất khó để phòng tránh. Do đó, trong nghiên cứu kháng đông lớn nhất hiện nay trên bệnh nhân rung nhĩ không do bệnh van tim với một nhánh điều trị bằng warfarin, INR dự định nằm trong khoảng 2.0-3.0 chiếm 66% [24] và mặc khác thường bằng nhau ở trên cũng như dưới khoảng tham chiếu.
Ngoài nỗi lo ngại các biến chứng chảy máu do thuốc, điều trị kháng vitamin K phù hợp liên quan một số cơ chế khác có thể góp phần sử dụng không đúng cách đã được chứng minh trên bệnh nhân rung nhĩ không do bệnh van tim [25]. Tóm lại, những trở ngại sử dụng kháng vitamin K trên bệnh nhân rung nhĩ không do bệnh van tim có thể liên quan bác sĩ cũng như bệnh nhân và hệ thống chăm sóc sức khỏe. Khi kết hợp lại, các yếu tố này làm hơn 50% bệnh nhân điều trị không đủ liều kháng vitamin K trong 1 nhóm đoàn hệ bệnh nhân rung nhĩ không do bệnh van tim.
Vai trò của thuốc kháng kết tập tiểu cầu
6 nghiên cứu ngẫu nhiên có đối chứng độc lập, trên 3000 bệnh nhân, đã khám phá tác dụng dự phòng của acetylsalicylic acid (hay aspirin, ASA) so với giả dược đối với nguy cơ thuyên tắc trên bệnh nhân rung nhĩ (hình 30.3) [16]. Mặc dù số lượng các biến cố ít hơn trong các nhánh ASA của tất cả nghiên cứu, chỉ có 1 nghiên cứu thu được kết quả khác biệt có ý nghĩa thống kê. Khi tổng hợp những kết quả của các nghiên cứu này thành 1 phân tích tổng hợp, khác biệt là đáng kể, tương ứng giảm nguy cơ tương đối là 22% (Hình 30.3) [16]. Có vài điểm khác biệt quan trọng trong 6 nghiên cứu này. 3 trong số chúng tương ứng khoảng 1/3 số bệnh nhân, đã nghiên cứu vai trò dự phòng thứ phát của ASA. Cũng như liều khác biệt rõ rệt trong các nghiên cứu, trong khoảng 50-1300mg/ngày.
So sánh trực tiếp các tác động của kháng vitamin K và ASA đã được thực hiện trong 5 nghiên cứu, chứng minh phương pháp điều trị trước đây vượt trội hơn rõ rệt trong việc giảm nguy cơ tương đối là 36% [16]. Mặc dù giảm nguy cơ sau điều trị ASA ở bệnh nhân rung nhĩ thì thấp hơn điều trị kháng vitamin K, nguy cơ xuất huyết lớn cũng thấp hơn [16]. Do đó, ASA được sử dụng trên bệnh nhân nguy cơ thuyên tắc từ thấp – trung bình mà còn trên bệnh nhân lo ngại nguy cơ chảy máu do dùng kháng vitamin K.
Vai trò của các thuốc kháng kết tập tiểu cầu khác, đặc biệt clopidorel, để dự phòng đột quỵ nguyên phát hoặc thứ phát trên bệnh nhân rung nhĩ đang chờ nghiên cứu thêm.
Kết hợp thuốc
Các nhà nghiên cứu đã cố thử nghiệm kết hợp một số thuốc bằng các cơ chế chống thuyên tắc do huyết khối khác nhau, hầu hết kết hợp kháng vitamin K liều thấp + một thuốc kháng kết tập tiểu cầu [3, 13, 16]. Không có nghiên cứu nào chứng minh bất kỳ hiệu quả vượt trội đối với kết hợp thuốc so với chỉ dùng kháng vitamin K có điều chỉnh liều trong dự phòng đột quỵ hoặc thuyên tắc trên bệnh nhân rung nhĩ không do bệnh van tim.
Nghiên cứu thuốc
Một số thuốc ức chế thrombin trực tiếp đường uống đã được phát triển như các thuốc khả thi thay thế cho kháng vitamin K. Gần đây, xime-lagatran được xét nghiệm trong các nghiên cứu lâm sàng cỡ mẫu lớn [24]. Vai trò kết hợp thuốc này nhằm thay thế kháng vitamin K đã được khám phá trong 2 nghiên cứu song song, gồm hơn 7000 bệnh nhân rung nhĩ không do bệnh van tim và ít nhất một yếu tố nguy cơ đột quỵ. Khi dữ liệu từ các nghiên cứu tổng hợp lại với nhau theo 1 quyết định được xác định trước, nguy cơ đột quỵ hoặc thuyên tắc hệ thống được nhận thấy thấp như nhau ở 2 nhóm điều trị [26]. Do đó, tỷ lệ biến cố hàng năm là 1.6%, một con số thấp hơn rõ rệt so với tỷ lệ dự đoán là 3.1%, được ước tính trong quá trình lập kế hoạch nghiên cứu từ tiêu chuẩn được sử dụng [27]. Khoảng 6% bệnh nhân tăng alanine aminotransferase gap 3 lần giới hạn trên mức bình thường, khiến 1/2 số bệnh nhân dừng điều trị theo tiêu chuẩn của các định nghĩa trước đây. Các giá trị alanine aminotransferase tăng lên rồi trở về bình thường theo cách tương tự, bất kể điều trị tiếp hoặc dừng.
Các thuốc ức chế thrombin trực tiếp khác cũng như thuốc ức chế yếu tố Xa đã được phát triển với mục tiêu thay thế kháng vitamin K hiện tại. Lợi ích tiềm năng của các thuốc này đang chờ các nghiên cứu lâm sàng.
Rung nhĩ kịch phát
Rung nhĩ kịch phát (PAF) không phải một bệnh cảnh xác định rõ ràng, bao gồm số lượng và thời gian của các đợt cấp riêng lẻ. Tỷ lệ thuyên tắc chưa được nghiên cứu đầy đủ liên quan đến thay đổi này. Bên cạnh đó, hiệu quả của điều trị dự phòng trên bệnh nhân rung nhĩ kịch phát không có bất kỳ bệnh nền rõ ràng nào ít được nghiên cứu hơn rung nhĩ vĩnh viễn.
Một nghiên cứu bệnh án hồi cứu hơn 400 bệnh nhân bị rung nhĩ kịch phát trên 25 năm [28]. Tất cả bệnh nhân đều có 1 vài bệnh nền, hầu hết là bệnh tim mạch, nhưng không điều trị dự phòng kháng vitamin K nguyên phát. Nghiên cứu nhấn mạnh một nguy cơ thuyên tắc khác nhau liên quan đến các giai đoạn khác nhau của rối loạn nhịp tim. Một nhóm huyết khối gây tắc mạch rõ rệt được phát hiện khi khởi phát rung nhĩ kịch phát, cụ thể là 6.8% sau 1 tháng. Sau đó, tỷ lệ thuyên tắc hàng năm dao động từ 0.6-2.6%. Sau khi chuyển thành rung nhĩ vĩnh viễn, cứ mỗi 3 bệnh nhân rung nhĩ kịch phát thì xuất hiện 1 người rung nhĩ vĩnh viễn, tỷ lệ thuyên tắc tăng lên mức cao hơn đáng kể. Một nghiên cứu khác cho thấy các yếu tố nguy cơ thuyên tắc trên hơn 700 bệnh nhân rung nhĩ kịch phát, đã xác định tỷ lệ thuyên tắc hàng năm là 2.2%, thường xảy ra ở nam trên 65 tuổi [29]. Điều quan trọng là những bệnh nhân không có bệnh nền có tỷ lệ biến cố thuyên tắc rất thấp (0.7% mỗi năm).
Vài nghiên cứu ngẫu nhiên có đối chứng được mô tả trước đây đánh giá hiệu quả của kháng vitamin K so với giả dược trên những bệnh nhân rung nhĩ từng cơn, tổng cộng 207 ca [3]. Tỷ lệ đột quỵ hàng năm trên những bệnh nhân này là 1.7% (điều trị kháng vitamin K) và 5.7% (trong nhóm chứng). Sử dụng phân tích đơn biến, rung nhĩ từng cơn không phải yếu tố nguy cơ đáng kể trong nhóm bệnh nhân đối chứng.
Do đó bằng chứng khuyến cáo điều trị dự phòng thuyên tắc trên bệnh nhân rung nhĩ kịch phát (PAF) vẫn rất hạn chế. Mặc dù vậy, các hướng dẫn hiện nay gợi ý dự phòng thuyên tắc do huyết khối thì phù hợp trên bệnh nhân PAF tái phát [18]. Rõ ràng là cần phải nghiên cứu thêm mối liên quan thật sự giữa loại và độ nặng của PAF, nguy cơ thuyên tắc và lợi ích cũng như dự phòng của điều trị kháng vitamin K.
Cuồng nhĩ
Tần số nhĩ trong cuồng nhĩ chậm hơn so với rung nhĩ. Về mặt lý thuyết, rối loạn nhịp này ít có nguy cơ tái tạo cơ tim tâm nhĩ, suy giảm chức năng LAA, hình thành huyết khối và thuyên tắc. Các nghiên cứu quan sát hoặc can thiệp tiền cứu quy mô lớn về tỷ lệ đột quỵ trong cuồng nhĩ còn thiếu. Tuy nhiên, nguy cơ đột quỵ liên quan cuồng nhĩ đã được nghiên cứu hồi cứu trong một nhóm lớn bệnh nhân lớn tuổi [30]. Bệnh án của hơn 17000 bệnh nhân cuồng nhĩ và 330000 bệnh nhân rung nhĩ cho thấy tỷ lệ nguy cơ đột quỵ giữa các quần thể này là 0.9.
Mặc dù kết quả điều trị kháng vitamin K chưa được nghiên cứu nhiều trong bệnh cảnh cuồng nhĩ, nhìn chung các nhà nghiên cứu khuyên dùng điều trị chống huyết khối trên bệnh nhân cuồng nhĩ tuân theo các quy tắc tương tự trên bệnh nhân rung nhĩ [18].
Sốc điện chuyển nhịp
Do đó, điều trị chống huyết khối được coi là bắc buộc trước khi chuyển nhịp bằng điện chọn lọc trên những ca rung nhĩ kéo dài quá 48h [18]. Bất chấp các biện pháp dự phòng, thuyên tắc được báo cáo khoảng 2% tất cả ca sốc điện chuyển nhịp [32]. Thuyên tắc thường xảy ra vào những ngày đầu sau khi xuất hiện lại nhịp xoang
Cơ chế gây thuyên tắc sau sốc điện chuyển nhịp rất phức tạp. Huyết khối tồn tại từ trước có thể bong ra khỏi thành nội tâm mạc khi tâm nhĩ tiếp tục chậm hơn hoặc đều đặn. Tuy nhiên, sau khi chuyển từ rung nhĩ sang nhịp xoang, chức năng cơ học của tâm nhĩ không được phục hồi ngay lập tức [33], tạo cơ hội hình thành huyết khối.
Nhấn mạnh tầm quan trọng của liều kháng đông đầy đủ tại thời điểm sốc điện chuyển nhịp. Trong tài liệu tổng hợp gồm hơn 2500 lần khử rung bằng dòng điện 1 chiều chọn lọc trên gần 2000 bệnh nhân, không có thuyên tắc sau sốc điện chuyển nhịp có thể xác nhận khi INR vượt quá 2.4 vào ngày thực hiện thủ thuật [34]. Ngược lại, thuyên tắc ngày càng phổ biến khi INR thấp và dường như tăng lên khi INR giảm (hình 30.6).
Các hướng dẫn hiện nay nêu rõ kháng vitamin K (INR 2.0-3.0) nên cho trong 3-4 tuần trước cũng như sau sốc điện chuyển nhịp trên bệnh nhân rung nhĩ trong hơn 48h hoặc khoảng thời gian không xác định [18]. Phát đồ này được khuyến cáo bất kể chuyển nhịp bằng thuốc hay sốc điện.
Sốc điện chuyển nhịp theo hướng dẫn của siêu âm tim qua thực quản (TOE)
Khoảng thời gian 3-4 tuần là đủ để dùng kháng đông trước chuyển nhịp có thể rút ngắn bằng cách sử dụng TOE.
Kỹ thuật này không chỉ bộc lộ huyết khối trong LAA hoặc tâm nhĩ trái một cách chính xác mà còn xác định các dấu hiệu hình thành huyết khối. Tính an toàn và khả năng ứng dụng của sốc điện chuyển nhịp theo hướng dẫn của TOE đã được chứng minh nhiều lần [35, 36]. Sau khi loại trừ bất kỳ huyết khối nào, kháng đông có thể bắt đầu dùng bằng heparin trọng lượng phân tử thấp [36, 37]. Việc tránh thuyên tắc trong 3-4 tuần sau sốc điện chuyển nhịp ngụ ý là kháng vitamin K bằng đường uống thường bắt đầu cùng lúc. Khi INR đạt đến mức mục tiêu dự định, duy trì kháng vitamin K như là phương pháp chống huyết khối gây tắc mạch duy nhất.
Các phương pháp kháng đông không dùng thuốc
Do LAA chứa phần lớn huyết khối của tất cả nhĩ trái trong các ca rung nhĩ không do bệnh van tim [5], các kỹ thuật khác nhau được phát triển với mục đích loại bỏ nguồn gây thuyên tắc này. Kết quả khi cắt bỏ LAA trên những bệnh nhân phẫu thuật tim vì các nguyên nhân khác đã được thử nghiệm trên hơn 400 bệnh nhân [38]. Không có đột quỵ được báo cáo sau phẫu thuật và có ý kiến cho rằng nên cắt bỏ LAA “một khi mở lồng ngực”. Các lập luận chống lại quan điểm này là nguy cơ tiềm tàng của cuộc phẫu thuật, khả năng cắt bỏ không hoàn toàn và loại bỏ một thành phần sinh lý trong điều hòa dịch cơ thể [39]. Việc sử dụng kĩ thuật này rộng rãi hơn phải chờ kết quả của nghiên cứu ngẫu nhiên đang tiến hành [40].
Các kỹ thuật không dùng thuốc khác để loại bỏ LAA như một vị trí gây huyết khối có thể xảy ra hiện đang được đánh giá trên lâm sàng, bao gồm phẫu thuật LAA qua nội soi lồng ngực [5] cũng như làm tắc LAA nội tâm mạc bằng các thiết bị khác nhau [41, 42
Các thiết bị được dùng để bít nội tâm mạc của tiểu nhĩ trái. Trái sang phải: thiết bị PLAATO, thiết bị Watchman và thiết bị Amplatzer. Thiết bị Amplatzer, ban đầu được thiết kế để bít lỗ thông liên nhĩ, được đặt vào trong đường vào của tiểu nhĩ trái. Sao chép dưới sự cho phép của Sievert cùng cộng sự [41]. Atritec Inc. và Meier cùng cộng sự [42].
Bằng chứng khoa học vững chắc/đồng thuận nhất trí
- Điều trị chống huyết khối (kháng đông dạng uống hoặc aspirin) đối với tất cả bệnh nhân rung nhĩ, ngoại trừ rung nhĩ đơn độc, để dự phòng thuyên tắc do huyết khối
- Cá nhân hóa lựa chọn thuốc kháng đông dựa vào đánh giá những nguy cơ chắc chắn đột quỵ và chảy máu và nguy cơ tương đối cũng như lợi ích đối với bệnh nhân cụ thể
- Điều trị kháng đông đường uống lâu dài với liều điều chỉnh để đạt được mục tiêu INR 2-3 trên những bệnh nhân nguy cơ đột quỵ cao, nếu không có chống chỉ định.
- Cần đánh giá lại nhu cầu dùng kháng đông định kỳ
- INR nên được xét nghiệm ít nhất hàng tuần khi bắt đầu điều trị kháng đông bằng đường uống và hàng tháng khi bệnh nhân đã ổn định
- Aspirin liều 325 mg hàng ngày là một lựa chọn thay thế trên bệnh nhân nguy cơ thấp hoặc những bệnh nhân có chống chỉ định kháng đông bằng đường uống.
- Kháng đông đường uống cho bệnh nhân rung nhĩ có bệnh van 2 lá do thấp hoặc van tim nhân tạo (van cơ học hoặc van mô)
- Dựa vào cường độ mục tiêu kháng đông trên từng loại van cơ học, nhưng không được thấp hơn 2-3
- Điều trị kháng đông bất kể phương pháp (điện học hoặc dùng thuốc) dùng để hồi phục lại nhịp xoang
- Bệnh nhân dùng kháng đông bị rung nhĩ kéo dài 48h hoặc khoảng thời gian không xác định trong ít nhất 3-4 tuần trước đó và sau khi sốc điện chuyển nhịp (INR 2-3)
- Tiến hành chuyển nhịp ngay lập tức trên bệnh nhân rung nhĩ cấp tính (khởi phát gần đây) kèm theo các triệu chứng cơ năng và triệu chứng thực thể có huyết động không ổn định gây ra cơn đau thắt ngực, nhồi máu cơ tim, sốc hoặc phù phổi, mà không cần đợi dùng kháng đông trước.
- Nếu không có chống chỉ định, sử dụng đồng thời heparin tiêm tĩnh mạch liều cao ban đầu, sau đó truyền liên tục với liều được điều chỉnh để kéo dài thời gian thromboplastin từng phần hoạt hóa 1.5-2 lần so với giá trị tham chiếu.
- Kế đến, dùng kháng đông dạng uống (INR 2-3) ít nhất 3-4 tuần, như ở bệnh nhân sốc điện chuyển nhịp.
- Các nghiên cứu gần đây có dữ liệu bị giới hạn ủng hộ tiêm dưới da heparin trọng lượng phân tử thấp trong những ca có chỉ định.
- Sàng lọc huyết khối tâm nhĩ trái hoặc tiểu nhĩ trái bằng siêu âm tim qua ngả thực quản (TOE) là một phương pháp thay thế cho
Các bằng chứng còn mâu thuẫn nhưng vẫn ủng hộ các hướng dẫn sau
- Mục tiêu INR thấp hơn 2 (dao động từ 1.6-2.5) để dự phòng ban đầu đột quỵ do thiếu máu cục bộ và thuyên tắc hệ thống trên bệnh nhân từ 75 tuổi trở lên cân nhắc tăng nguy cơ các biến chứng do xuất huyết nhưng không có chống chỉ định rõ ràng với kháng đông dạng uống.
- Điều trị chống huyết khối trên bệnh nhân cuồng nhĩ, nhìn chung giống điều trị rung nhĩ.
- Lựa chọn thuốc chống huyết khối đều chung tiêu chuẩn bất kể dạng rung nhĩ (ví dụ bệnh nhân rung nhĩ có van cơ học, rung nhĩ kéo dài hoặc vĩnh viễn)
Các bằng chứng mâu thuẫn, ít được củng cố tốt
- Ngừng thuốc kháng đông trong thời gian tối đa 1 tuần đối với các loại phẫu thuật hoặc thủ thuật để chẩn đoán bệnh có nguy cơ chảy máu, mà không dùng heparin thay thế trên bệnh nhân rung nhĩ không có van tim cơ học
- Sử dụng heparin không phân đoạn hoặc trọng lượng phân tử thấp, tương ứng tiêm mạch và tiêm dưới da, trên những bệnh nhân nguy cơ cao được lựa chọn hoặc khi một loạt thủ thuật yêu cầu phải ngưng kháng đông dạng uống kéo dài hơn 1 tuần.
- Điều trị bệnh nhân có bệnh mạch vành bằng kháng đông (INR 2-3) dựa trên tiêu chuẩn tương tự với bệnh nhân không mắc bệnh mạch vành
- (a) Aspirin liều thấp (< 100 mg/ngày) hoặc clopidogrel (75 mg/ngày) có thể dùng đồng thời với thuốc kháng đông, nhưng các chiến lược này không được đánh giá đầy đủ và có thể liên quan tăng nguy cơ chảy máu.
- Điều trị aspirin là không bắt buộc để dự phòng nguyên phát đột quỵ trên bệnh nhân dưới 60 tuổi mà không có bệnh tim hoặc các yếu tố nguy cơ thuyên tắc do huyết khối (rung nhĩ đơn độc)
- Tiến hành chuyển nhịp mà không theo hướng dẫn của siêu âm tim qua ngả thực quản (TOE) trong 48h đầu sau khởi phát rung nhĩ
- (a) Trong các ca này, kháng đông trước và sau chuyển nhịp thì không bắt buộc, dựa vào đánh giá nguy cơ
- Kháng đông trên bệnh nhân cuồng nhĩ trải qua chuyển nhịp giống với bệnh nhân rung nhĩ
Bằng chứng/đồng thuận là kháng đông không có ích, có thể thậm chí gây hại
1 Kéo dài kháng đông để dự phòng đột quị trên bệnh nhân 60 tuổi mà không có bệnh van tim (rung nhĩ đơn độc) và không có yếu tố nguy cơ thyên tắc do huyết khối
INR, tỷ lệ chuẩn hóa quốc tế; TOE, siêu âm tim qua ngả thực quản
Adapted with permission from Fuster etal. [18].
Kiểm soát nhịp và tần số tim
Không phụ thuộc nhu cầu thuốc kháng đông, có 2 cách chính để điều trị rung nhĩ là (1) phục hồi và duy trì nhịp xoang và (2) kiểm soát tần số thất khi cho phép rung nhĩ vĩnh viễn. Các lợi ích về mặt lý thuyết của kiểm soát nhịp nhiều hơn kiểm soát tần số bao gồm giảm các triệu chứng, dự phòng huyết khối và tránh bệnh cơ tim. Chiến lược nào được ưu tiên hơn trong điều trị lâu dài vẫn còn gây tranh cãi bất chấp các thử nghiệm công bố gần đây đã giải quyết vấn đề này [43, 46].
Các nghiên cứu này đã trả lời một số câu hỏi nhưng lại xuất hiện các câu hỏi khác gây cản trở hình thành một kết luận chính xác trong thực hành lâm sàng hiện nay.
Thật vậy, tất cả 4 nghiên cứu không tìm thấy điểm khác biệt giữa hai chiến lược về các tiêu chí chính khác nhau, như không cải thiện triệu chứng [43], tỷ lệ tử vong chung [46] hoặc kết hợp các biến cố gồm tử vong và thuyên tắc hệ thống [43]. Tuy nhiên, các bệnh nhân kiểm soát nhịp cần phải nhập viện [43, 44] và phải được điều trị các biến cố bất lợi liên quan [43, 45, 46]. Mặc khác, khi được phân tích theo nhịp, các điểm bất lợi chính xảy ra ít thường xuyên hơn trên những bệnh nhân nhịp xoang cả trong STAF [44] và AFFIRM [46, 47]. Do đó các kết quả có thể tốt hơn trong nhóm kiểm soát nhịp nếu duy trì nhịp xoang trong một nhóm lớn bệnh nhân.
Cách tiếp cận kiểm soát tần số được đề xuất như điều trị đầu tay ở bệnh nhân lớn tuổi (>70) hoặc các bệnh nhân có triệu chứng tối thiểu, trong khi chiến lược kiểm soát nhịp được chứng minh sau một đợt rung nhĩ đầu tiên hoặc khi các triệu chứng không thể cải thiện thỏa đáng bằng bằng cách kiểm soát tần số [18].
Chuyển nhịp xoang
Sốc điện chuyển nhịp thường được thực hiện có chọn lọc để phục hồi nhịp xoang trên bệnh nhân rung nhĩ kéo dài. Tuy nhiên đôi khi sốc điện chuyển nhịp phải làm khẩn cấp khi rối loạn nhịp là yếu tố chính gây suy tim cấp, tụt huyết áp hoặc làm trầm trọng thêm cơn đau thắt ngực. Sinh lý bệnh của các bệnh cảnh lâm sàng này liên quan đến tần số thất nhanh do rung nhĩ và/hoặc mất sự hỗ trợ của nhĩ để đổ đầy thất trái. Sau cùng là có tầm quan trọng đặc biệt trong suy giảm huyết động trên bệnh nhân mắc bệnh cơ tim phì đại, hẹp van 2 lá, bệnh cơ tim hạn chế, tăng huyết áp hoặc bệnh nhân bị nhồi máu cấp thành dưới có tổn thương thất phải. Do đó, cần thiết phải sốc điện chuyển nhịp khẩn cấp thường được khuyến khích trên bệnh nhân có bệnh nền là bệnh tim cấu trúc, mặc dù một tình huống như vậy cũng có thể quan sát trên bệnh nhân rung nhĩ hoặc cuồng nhĩ và dẫn truyền nhanh đường phụ nhĩ thất (hội chứng Wolf – Parkinson – White) và một trái tim bình thường. Các khuyến cáo sốc điện chuyển nhịp đối với rung nhĩ bắt nguồn từ Hiệp hội Tim mạch Hoa Kỳ (AHA), Trường môn tim mạch Hoa Kỳ (ACC) và Hiệp hội tim mạch châu Âu (ESC) [18] được liệt kê trong bảng 30.3.
Sau khi quyết định chuyển nhịp cho bệnh nhân, nên quyết định liệu thực hiện thủ thuật có nên dùng thuốc chống loạn nhịp hoặc sốc điện trực tiếp hay không.
Với mục đích này, các lợi ích và bất lợi của 2 kĩ thuật này nên được đánh giá cần thận. Tóm lại, sốc điện chuyển nhịp hiệu quả hơn dùng thuốc và có hiệu quả tức thời, nhưng thường yêu cầu phải gây mê hoặc thuốc an thần nặng. Với chuyển nhịp bằng thuốc chống loạn nhịp, thời gian sốc điện không thể dự đoán trước và các biến cố bất lợi liên quan tiền loạn nhịp hoặc giảm co bóp cơ tim có thể xảy ra. Liên quan đến lựa chọn giữa cách tiếp cận bằn thuốc và sốc điện, ổn định huyết động và thời gian rối loạn nhịp là 2 thông số quan trọng nhất để đưa ra quyết định điều trị. Chuyển nhịp ngay lập tức sử dụng sốc điện thay vì dùng thuốc tiêm tĩnh mạch được chỉ định khi có rối loạn huyết động. Bởi vì chuyển nhịp bằng chất hóa học ít có khả năng thành công, chuyển nhịp bằng sốc điện cũng có thể là lựa chọn hàng đầu trên bệnh nhân rung nhĩ kéo dài (long- lasting AF).
Thuốc sốc điện chuyển nhịp
Trước năm 1963, khi chuyển nhịp bằng sốc điện không có sẵn, các thuốc rối loạn nhịp là lựa chọn ưu tiên và duy nhất. Rung nhĩ tự khỏi được quan sát gần 70% bệnh nhân trong 24h sau khi khởi phát triệu chứng rung nhĩ [48]. Khả năng chuyển nhịp tự nhiên sẽ giảm liên quan đến thời gian rối loạn nhịp, với kết quả chỉ trên 45% bệnh nhân khởi phát trung nhĩ 24-72h trước đó sẽ tự chấm dứt rối loạn nhịp tim [48]. Sau 7 ngày rung nhĩ liên tục, khả năng nhịp xoang sẽ tự phục hồi quá thấp đến nỗi rối loạn nhịp sau đó được định nghĩa là Rung nhĩ “vĩnh viễn” trong phân loại hiện nay [49].
Thú vị là các thuốc rối loạn nhịp hiệu quả đối với chuyển nhịp trên bệnh nhân rung nhĩ cũng dựa vào thời gian rung nhĩ, điều trị hiệu quả hơn trong vòng 7 ngày đầu sau khi khởi phát rối loạn nhịp. Do đó, các thuốc chuyển nhịp có thể đạt hiệu quả đến 71% trên bệnh nhân mới khởi phát rung nhĩ gần đây nhưng chỉ đạt hiệu quả 35% bệnh nhân khi rung nhĩ vĩnh viễn [50].
Các thuốc chống rối loạn nhịp được phê chuẩn hiệu quả với chuyển nhịp trong rung nhĩ và được khuyến cáo trong các hướng dẫn AHA/ACC/ESC trong bảng 30.4 và 30.5. Hội đồng ESC và các thành viên của AHA/ACC tuyên bố rằng propaferone, flexainide, ibutilide hoặc dofetilide nên là lựa chọn đầu tay (mức khuyến cáo I), ngược lại amiodarone nên là lựa chọn thứ 2 (mức khuyến cáo IIa) khi cân nhắc chuyển nhịp bằng thuốc với rung nhĩ gần đây (thời gian <7 ngày). Trên bệnh nhân rung nhĩ kéo dài (> 7 ngày), lựa chọn thuốc chống loạn nhịp bị giới hạn với dofetilide (mức khuyến cáo I), ibutilide và amiodarone (mức khuyến cáo IIa). Với mỗi thuốc, liều khuyến cáo và đường dùng được liệt kê trong bảng 30.6.
Deneer cùng cộng sự đã xem lại các nghiên cứu lâm sàng từ năm 1966 đến 2001 với các thuốc uống chống loạn nhịp điều trị chuyển nhịp trong rung nhĩ mới mắc. Uống sotalol, digoxin và verapamil không hiệu quả trong chuyển rung nhĩ về nhịp xoang.
Trong số các thuốc được chấp thuận có hiệu quả (so với giả dược) chuyển nhịp trong rung nhĩ mới khởi phát, tỷ lệ chuyển nhịp bằng thuốc uống liều nạp propafenone 600 mg đã thay đổi từ 37%-41% trong 4h và sau 1 liều uống duy nhất flecainide 300 mg nhịp xoang được phục hồi ở 59-68% bệnh nhân sau 3h.
Khi tiêm tĩnh mạch các thuốc chống loạn nhịp, nhịp xoang có thể được phục hồi trong 1 khoảng thời gian rất ngắn. Tỷ lệ chuyển nhịp liên quan thời gian sau khi truyền dường như cao hơn [52] ở các thuốc mức IC (flecainide và propafenone) so với các thuốc nhóm IA (procainamide, quinidine) hoặc các thuốc nhóm III (amiodarone, dofetilide, ibutilide, sotalol) (hình 30.8). Do đó, trong 1h sau truyền, nhịp xoang được phục hồi trong 50-90% bệnh nhân dùng flecainide hoặc propafenone. Cần đặc biệt chú ý amiodarone liên quan khởi phát chuyển nhịp muộn (hình 30.8). Flecainide tiêm tĩnh mạch hiệu quả hơn giả dược, verapamil, digoxin, procainamide, propafenone và amiodarone và hiệu quả và an toàn như ibutilide [53].
Lựa chọn thuốc nào để chuyển nhịp bằng thuốc dựa vào không chỉ tính hiệu quả mà còn độ an toàn (xem bảng 30.6), chống chỉ định và giá thành. Đối với giá thành người ta đang quan ngại, chi phí điều trị bằng ibutilide mắc hơn, gấp 30 lần các thuốc chống rối loạn nhịp khác. Các thuốc chống rối loạn nhịp mức IC (flecainide và propafenone) không nên được kê đơn nếu có suy tim (hoặc suy chức năng tim mạch), thiếu máu cục bộ cấp tính, hội chứng bệnh lý nút xoang đã biết từ trước hoặc có rối loạn dẫn truyền nhĩ thất. Amiodarone được khuyến cáo dùng trên bệnh nhân rối loạn huyết động do tác dụng giảm co bóp. Một lợi ích khác của amiodarone là khả năng làm chậm dẫn truyền nhĩ thất và kiểm soát tần số thất.
Hạ huyết áp, cuồng nhĩ dẫn truyền nhanh
Hình 30.8 Tỷ lệ chuyển nhịp của rung nhĩ kịch phát (< 3 ngày) liên quan đến thời gian sau khi bắt đầu truyền tĩnh mạch có thể thấy trong các nghiên cứu về tính hiệu quả của các thuốc nhóm IC (flecainide, propafenone), các thuốc nhóm IA và III (procainamide, quinidine, sotalol, ibutilide, dofetilide) và amiodarone được trình bày. Đường cong biểu thị chuyển nhịp bằng giả dược được xây dựng từ tỷ lệ chuyển nhịp bằng giả dược. Các thuốc mức IC tỏ ra hiệu quả nhất. Chú ý chuyển nhịp bắt đầu muộn với amiodarone. Được chấp thuận bởi Fresco cùng cộng sự [52].
Sốc điện chuyển nhịp
Vào năm 1963, Lown lần đầu tiên báo cáo sốc điện chuyển nhịp rung nhĩ bằng dòng điện 1 chiều [54]. Thuật ngữ “sốc điện chuyển nhịp bằng dòng điện 1 chiều” nghĩa là phát ra một cú sốc điện đồng bộ hóa với hoạt động nội tại của tim để tránh phóng điện trong giai đoạn dễ bị tổn thương, khi có nguy cơ vô tình gây rung thất. Thường thì sóng R của bề mặt điện tâm đồ được chọn cho sự đồng bộ hóa này vì máy khử rung tim có thể dễ dàng cảm nhận được.
Sốc điện chuyển nhịp bằng dòng điện bên ngoài được thực hiện bằng các miếng đệm điện cực dưới da đặt trực tiếp trên thành ngực. Sốc điện chuyển nhịp được thực hiện trên bệnh nhân nhịn ăn và gây mê toàn thân đầy đủ (hoặc an thần) để tránh đau liên quan dòng điện sốc điện. Sự thành công của sốc điện chuyển nhịp được xác định bằng mật độ dòng điện chạy qua cơ của buồng khử rung tim. Cường độ dòng điện chạy qua phụ thuộc vào dạng sóng đầu ra, mức năng lượng đã chọn và kháng trở xuyên lồng ngực. Kháng trở càng cao, dòng điện chạy qua càng thấp. Các yếu tố chính quyết định kháng trở xuyên lồng ngực gồm thể trạng cơ thể, sự tương quan giữa điện cực và da, kích thước và vị trí của miếng dáng điện cực. Để sốc điện chuyển nhịp thành công, một lượng lớn cơ tâm nhĩ phải được bao phủ bởi điện cực. Đây là lý do căn bản sử dụng bản điện cực (paddle) trước sau hơn là vị trí trước bên. Tuy nhiên, một số nghiên cứu lâm sàng ngẫu nhiên [55-57] đã cho thấy thành công tốt hơn với cấu hình trước sau, trong khi các nghiên cứu khác [58-60] quan sát thấy không có sự khác biệt liên quan vị trí bản điện cực. Bởi vì vị trí bản điện cực trước sau chưa bao giờ được chứng minh tệ hơn so với điện cực trước bên, cấu hình này là lựa chọn đầu tiên trong thực hành lâm sàng.
Vì cấu hình điện cực tối ưu cho bệnh nhân nhất định không được biết trước khi sốc điện, bác sĩ lâm sàng nên cân nhắc sắp xếp vị trí thay thế nếu vị trí ban đầu không thành công. Để tối ưu cơ tâm nhĩ càng nhiều càng tốt, Mehdirad cùng cộng sự [61] gần đây đã chỉ ra việc tối ưu hóa vị trí điện cực sử dụng phương pháp soi huỳnh quang dẫn đến nâng cao tỷ lệ thành công sốc điện chuyển nhịp.
Hầu hết các thiết bị để sốc điện chuyển nhịp bên ngoài đều cung cấp dòng điện có dạng sóng 1 pha (hình 30.9) với công suất năng lượng tối đa 360J. Tỷ lệ thành công sốc điện chuyển nhịp trong rung nhĩ dai dẳng thường khoảng 80% [62-64]. Thành công của sốc điện chuyển nhịp liên quan nhiều thông số lâm sàng. Do đó, sốc điện chuyển nhịp trong rung nhĩ dai dẳng khó có thể thành công trên bệnh nhân có thời gian rung nhĩ kéo dài > 3 năm hoặc kích thước nhĩ trái > 60mm. Các yếu tố tiên lượng thất bại bao gồm thời gian loạn nhịp kéo dài, lớn nhĩ trái, có bệnh tim trước đó, tim to và béo phì [62, 65].
Hình 30.9 Dạng sóng 1 pha và 2 pha. Sao chép dưới sự cho phép của Niebauer cùng cộng sự Am J Cardiol 2004; 93: 1495-1499.
Một cú sốc điện 100J là quá thấp để thành công nên người ta khuyến cáo mức sốc điện ban đầu điều trị rung nhĩ là 200J. Bởi vì tổn thương da tại điểm tiếp xúc điện cực và da sẽ tăng khi mức năng lượng cao hơn, một số bác sĩ lâm sàng sử dụng cách tiếp cận năng lượng từng bước, khởi đầu bằng sốc điện 200J và tăng năng lượng theo từng mức 100J cho đến đạt tối đa 400J (năng lượng lưu trữ 400J tương đương 360J năng lượng phân bố). Ngoài ra, bắt đầu với mức năng lượng cao có thể giảm số lần sốc điện.
Loại hiện đại nhất của máy khử rung ngoài cơ thể cung cấp dòng điện dạng sóng 2 pha (hình 30.9). Mức năng lượng tối đa được giới hạn ở 200J. Gần đây các thử nghiệm ngẫu nhiên [66-68] đã chỉ ra các máy khử rung 2 pha có hiệu quả hơn, đòi hỏi ít sốc điện hơn và cung cấp năng lượng thấp hơn và kết quả bỏng da thấp hơn so với các máy khử rung 1 pha. Hiệu quả của sốc điện chuyển nhịp xuyên thành ngực cao hơn 90% với dạng sóng 2 pha.
Sau 1 hoặc 2 lần thất bại sốc điện chuyển nhịp bằng mức năng lượng cao nhất ở cả 2 vị trí điện cực, các thuốc chống rối loạn nhịp trước khi sốc điện thêm, các cú sốc điện gấp đôi (cung cấp năng lượng khi sử dụng 2 máy khử rung) hoặc cân nhắc sốc điện chuyển nhịp từ bên trong. Vào năm 1988, Levy cùng cộng sự đã giới thiệu sốc điện chuyển nhịp từ bên trong điều trị rung nhĩ bằng cách sử dụng năng lượng cao (200-300J) dòng điện 1 chiều giữa một catheter đặt tại nhĩ phải và một tấm che phía sau. Trong một thử nghiệm ngẫu nhiên sử dụng máy khử rung đơn pha để sốc điện chuyển nhịp từ bên trong trong nhóm chứng, tỷ lệ chuyển nhịp cấp cao hơn được quan sát trong nhóm sốc điện chuyển nhịp từ bên trong 2 pha (91% vs. 67%, P = 0.002), đặc biệt trên bệnh nhân béo phì và bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính. Cho đến nay sốc điện chuyển nhịp từ bên trong đã không được thử nghiệm chống lại quá trình sốc điện chuyển nhip 2 pha bên ngoài. Các kỹ thuật khác để sốc điện chuyển nhịp từ bên trong áp dụng mức năng lượng thấp (<20J) thông qua một catheter điện cực lớn trên bề mặt (cực âm) ở tâm nhĩ phải và một catheter khác (cực dương) đặt trong xoang vành hoặc động mạch phổi trái [71-73]. Một lợi ích tiềm năng là sốc điện chuyển nhịp bên trong năng lượng thấp không yêu cầu gây mê toàn thân nhưng có thể làm khi dùng an thần nhẹ. Sốc điện chuyển nhịp qua thực quản cũng được nghiên cứu như một cách tiếp cận thay thế sốc điện chuyển nhịp bên ngoài. Với kỹ thuật này, mức năng lượng trung bình (20-50J) được cung cấp giữa các điện cực thực quản và một miếng đắp giữa xương ức. Người ta đã chứng minh kỹ thuật này an toàn và hiệu quả [74, 75] và có thể kết hợp với hình ảnh siêu âm qua thực quản [76] để loại trừ huyết khối ngay trước khi sốc điện chuyển nhịp.
Việc dùng các thuốc chống rối loạn nhịp đã được đề xuất như chiến lược bổ trợ (điều trị lai) để nâng cao hiệu quả sốc điện chuyển nhịp (bảng 30.7). Một lợi ích tiềm năng của cách tiếp cận này là có thể ngăn các tái phát bán cấp sau khi chuyển nhịp vì nồng độ huyết tương đầy đủ có mặt tại thời điểm phục hồi nhịp xoang. Ngược lại, các thuốc chống rối loạn nhịp liên quan nguy cơ thúc đầy rối loạn nhịp và có thể tăng ngưỡng rung nhĩ (đặc biệt các thuốc nhóm IC). Trong các thử nghiệm lâm sàng ngẫu nhiên đã đánh giá hiệu quả của các thuốc chống rối loạn nhịp trước khi sốc điện chuyển nhịp bằng dòng điện 1 chiều so với chỉ đơn thuần sốc điện chuyển nhịp bằng dòng điện 1 chiều, không có loại nào được chứng minh hiệu quả tăng lên khi bổ sung quinidine, propafenone, flecainide hoặc sotalol [77, 78]. Một nghiên cứu chứng minh nâng cao hiệu quả khi dùng ibutilide trước khi điều trị [79]. Tiền điều trị bằng amiodarone [80, 81] cũng liên quan nâng cao hiệu quả của sốc điện chuyển nhịp. Mặc dù chưa được chứng minh rõ, điều trị bằng thuốc chống rối loạn nhịp có thể được dùng ban đầu trước khi sốc điện chuyển nhịp để tạo điều kiện duy trì nhịp xoang sau sốc điện.
Đoạn ST chênh lên thoáng qua có thể xuất hiện trên ECG sau sốc điện chuyển nhịp và có thể tăng creatinin kinase trong khi mức troponin T và troponin I thì không. Tổn thương cơ tim liên quan sốc điện chuyển nhịp không được quan sát thấy ở mức độ vi mô.
Sốc điện chuyển nhịp chống chỉ định trong trường hợp ngộ độc digitalis do sốc điện bằng dòng điện 1 chiều có thể gây rối loạn nhịp thất ác tính. Tuy nhiên, thường không cần thiết ngưng dùng digoxin trước sốc điện chọn lọc trong rung nhĩ bởi vì lượng digoxin huyết thanh trong phạm vi đều trị thì không liên quan gây rối loạn nhịp thất ác tính trong quá trình sốc điện. Vì hạ kali máu có thể dự báo rối loạn nhịp thất ác tính sau sốc điện, nên nồng độ kali máu phải trong giới hạn bình thường trước khi sốc điện chuyển nhịp bằng dòng điện 1 chiều. Ưu tiên thuốc kháng đông thích hợp trước khi sốc điện chuyển nhịp là bắc buộc (xem ở trên).
Dự phòng tái phát
Sau khi chuyển nhịp thành công
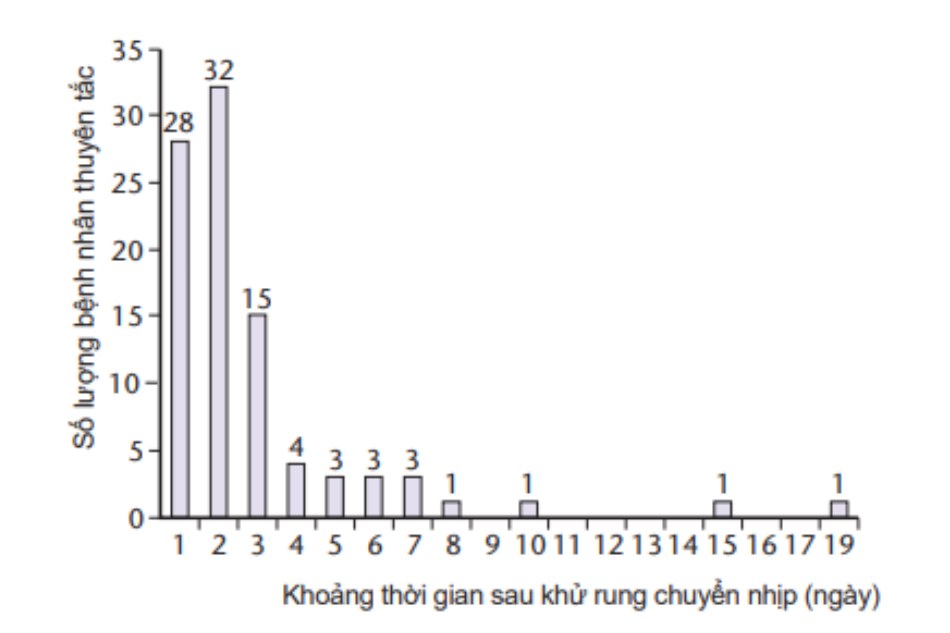
Các nghiên cứu sau sốc điện chuyển nhịp [84-87] đã thành lập một vài mô hình tái phát sau sốc điện chuyển nhịp (hình 30.10) trong rung nhĩ dai dẳng. Trên một số bệnh nhân rung nhĩ tái phát trong vòng vài phút sau khoảng thời gian về lại nhịp xoang (rung nhĩ tái phát tức thì, IRAF), ở các bệnh nhân khác tái phát muộn hơn trong vòng 2 phút đến 2 tuần (rung nhĩ tái phát bán cấp, SRAF) và cuối cùng tái phát muộn có thể được quan sát là > 2 tuần. IRAF xuất hiện khoảng 15-20% bệnh nhân trải qua sốc điện chuyển nhịp, SRAF chiếm khoảng 25-35% và tái phát muộn khoảng 10-20%.
Hình 30.10 Minh họa giả thuyết về kết cục rối loạn nhịp sau khi sốc điện chuyển nhịp. 3 loại tái phát rung nhĩ sau sốc điện chuyển nhịp điều trị rung nhĩ kéo dài được mô tả (ngay lập tức, bán cấp và muộn). EVC, sốc điện chuyển nhịp bên ngoài; IRAF, rung nhĩ tái phát ngay lập tức sau khi sốc điện chuyển nhip; SR, nhịp xoang.
Chỉ gần đây các nghiên cứu ngẫu nhiên mới giải quyết cụ thể các vấn đề của IRAF, SRAF và các nghiên cứu có đối chứng vẫn cần để xác định phương pháp điều trị hiệu quả nhất các dạng rung nhĩ tái phát này. Các thuốc chống loạn nhịp được chứng minh có hiệu quả dự phòng IRAF [18, 88] bao gồm quinidine, propafenone (đơn trị liệu hoặc dùng với verapamil), flecainide, sotalol, amiodarone và ibutilide. Các thuốc này được chứng minh (xem bảng 30.70 dự phòng IRAF sau khi sốc điện chuyển nhịp trong các hướng dẫn gần đây [18]. Các thuốc tương tự cũng cho thấy hiệu quả trong dự phòng SRAF, ngoại trừ ibutilide [88]. 2 công bố gần đây [89, 90] quan sát thấy các thuốc chẹn beta cũng hiệu quả trong dự phòng SRAF sau sốc điện chuyển nhịp. Thuốc chẹn beta, amiodarone, sotalol, flacainide, propafenone và quinidine đã được chấp thuận (xem bảng 30.7) để dự phòng SRAF trong các hướng dẫn gần đây của AHA/ACC/ESC [18].
Bệnh nhân nào nên uống thuốc điều trị chống rối loạn nhịp trước khi sốc điện chuyển nhịp để dự phòng IRAF hoặc SRAF vẫn chưa có câu trả lời. Điều trị trước dường như thích hợp nhất trên bệnh nhân trước đây không đáp ứng với sốc điện chuyển nhịp và những bệnh nhân rung nhĩ tái phát tức thì hoặc bán cấp.
Điều trị phối hợp cũng có thể được quan tâm để dự phòng rung nhĩ tái phát sớm sau khi sốc điện chuyển nhịp thành công. Một thử nghiệm ngẫu nhiên gần đây [91] đã so sánh amiodarone đơn thuần và amiodarone cộng với enalapril để dự phòng rung nhĩ tái phát trên những bệnh nhân rung nhĩ dai dẳng lâu năm. Người ta quan sát thấy xu hướng giảm IRAF nhưng SRAF giảm đáng kể, với kết quả 84.3% bệnh nhân điều trị kết hợp thuốc giúp duy trì nhịp xoang trong 4 tuần so với chỉ 61.3% bệnh nhân điều trị amiodarone đơn thuần (P=0.002). Cho đến nay cả enalapril và bất kể thuốc tương tự nào đều không được công nhận là hiệu quả dự phòng IRAF hoặc SRAF.
Những bệnh nhân có tỷ lệ sốc điện chuyển nhịp thành công, được định nghĩa là những người chọn cách tiếp cận kiểm soát nhịp để điều trị rối loạn nhịp. Do đó, các bệnh nhân này một cách hợp lý nên điều trị thuốc chống rối loạn nhịp lâu dài để dự phòng rung nhĩ tái phát, ngoại trừ bệnh nhân mới phát hiện rung nhĩ (xem bên dưới). Tỷ lệ sống không bị rối loạn nhịp trong vòng 4 năm không vượt quá 10% bệnh nhân ban đầu điều trị bằng duy nhất một lần sốc điện chuyển nhịp và không điều trị dự phòng. Tuy nhiên, thậm chí trên bệnh nhân được thử nghiệm thuốc hàng loạt và bổ sung sốc điện chuyển nhịp nếu cần thiết, tỷ lệ sống không bị rối loạn nhịp trong vòng 4 năm chỉ khoảng 30% (hình 30.11).
Các nghiên cứu tiền cứu trên bệnh nhân rung nhĩ dai dẳng cho thấy hầu hết các thuốc chống rối loạn nhịp đều hiệu quả như nhau, ngoại trừ amiodarone có hiệu quả vượt trội so với các thuốc chống rối loạn nhịp nhóm I hoặc sotalol [92, 94]. Các nghiên cứu hiệu quả của thuốc bao gồm sự kết hợp bệnh nhân rung nhĩ kịch phát hoặc dai dẳng và hầu hết cho ra kết quả tổng thể (bảng 30.8). Do đó, thông tin về hiệu quả của thuốc nhìn chung không có sẵn ở nhóm bệnh nhân chỉ rung nhĩ dai dẳng. Điều này cũng đúng trên bệnh nhân rung nhĩ kịch phát. Điều này cản trở việc đánh giá cụ thể các chiến lược điều trị. Tài liệu hiệu quả các thuốc chống rối loạn nhịp và khả năng dung nạp để dự phòng rung nhĩ tái phát được thảo luận dưới đây.
Rung nhĩ kịch phát nên được xem xét như một bệnh mạn tính vì trên 90% bệnh nhân sẽ bị tái phát sau đợt đầu tiên. Do đó, hầu hết bệnh nhân rung nhĩ sẽ phải điều trị dự phòng bằng các thuốc chống rối loạn nhịp nếu duy trì nhịp xoang có ý nghĩa lâm sàng. Các yếu tố liên quan tăng nguy cơ rung nhĩ tái phát gồm tuổi cao, tăng huyết áp, phì đại nhĩ trái, tiền sử suy tim và rối loạn chức năng thất trái.
Điều trị dự phòng bằng thuốc thường được khuyến cáo trong các trường hợp cơn rung nhĩ lần đầu phát hiện. Các thuốc chống loạn nhịp cũng có thể tránh không dùng ở rung nhĩ không thường xuyên và rung nhĩ kịch phát dung nạp tốt. Quyết định dùng thuốc chống loạn nhịp để duy trì nhịp xoang chủ yếu dựa vào sự xuất hiện các triệu chứng mất khả năng liên quan cơn rung nhĩ (khuyến cáo nhóm I, mức bằng chứng B, khuyến cáo AHA/ACC/ESC). Lựa chọn một thuốc cụ thể nên dựa vào gánh nặng rối loạn nhịp tim, loại bệnh tim nền, mức độ nặng của triệu chứng, các biến cố bất lợi và lựa chọn của bệnh nhân.
Xét về hiệu quả điều trị, rung nhĩ tái phát không đồng nghĩa điều trị thất bại.Thật vậy, bệnh nhân rung nhĩ tái phát có thể thích tiếp tục điều trị bằng thuốc do các cơn rung nhĩ ít xảy ra, thời gian ngắn hơn hoặc liên quan các triệu chứng nhẹ hơn. Giảm gánh nặng rối loạn nhịp có thể tạo sự điều trị thành công đối với vài bệnh nhân, trong khi đó bất kỳ rung nhĩ tái phát nào có vẻ không thể dung nạp với các bệnh nhân khác.
Một phân tích tổng hợp gần đây của các thử nghiệm lâm sàng ngẫu nhiên [77] có thể xác định 30 thử nghiệm (18 thử nghiệm với nhóm chứng) đã đánh giá các thuốc chống rối loạn nhịp để duy trì nhịp xoang trên bệnh nhân rung nhĩ kịch phát hoặc rung nhĩ dai dẳng. Bằng chứng mạnh mẽ về tính hiệu quả được quan sát trên amiodarone, propafenone, disopyramide và sotalol, trong khi hiệu quả vừa phải ghi nhận với flecainide, quinidine và azimilide (xem bảng 30.8). Chỉ có 3 ngiên cứu so sánh trực tiếp các thuốc chống loạn nhịp có ý nghĩa thống kê về sự khác biệt giữa các thuốc. 2 nghiên cứu báo cáo hiệu quả cao hơn đối với amiodarone so với sotalol hoặc propafenone và 1 nghiên cứu thấy propafenone hiệu quả hơn quinidine. Digoxin và các thuốc kháng kênh canxi (diltiazem và verapamil) không hiệu quả để duy trì nhịp xoang trên bệnh nhân rung nhĩ kịch phát hoặc rung nhĩ dai dẳng [18]. Các thuốc chẹn beta thường không thành công để dự phòng rung nhĩ tái phát, ngoại trừ trên bệnh nhân rung nhĩ qua trung gian adrenergic mà chẹn beta là thuốc lựa chọn đầu tiên.
Các thuốc chống rối loạn nhịp được liệt kê trong bảng 30.8 tăng thời gian rung nhĩ tái phát đầu tiên và giảm số lượng các biến cố tái phát so với giả dược, nhưng các kết quả này nhìn chung kém hiệu quả. Do đó, sau 6 tháng điều trị, rung nhĩ tái phát được ghi nhận ở 70% bệnh nhân điều trị bằng giả dược và trung bình 50% bệnh nhân dùng thuốc liên tục. Dựa vào các đặc điểm lâm sàng của quần thể nghiên cứu và sự khác nhau của các thuốc chống rối loạn nhịp, tỷ lệ rung nhĩ tái phát trong 6 tháng thay đồi từ 23-64% trong y văn.
Hiệu quả không phải là điều cân nhắc duy nhất sau khi điều trị ban đầu bằng các thuốc chống rối loạn nhịp.Thật vậy, an toàn là điều tối quan trọng vì các biến chứng nặng có thể xuất hiện trong suốt quá trình điều trị, đặc biệt sau khi rối loạn nhịp nặng. Một phân tích tổng hợp [95] của các thử nghiệm lâm sàng ngẫu nhiên cho thấy tăng tỷ lệ tử vong liên quan quininide và trong thử nghiệm AFFIRM [46] có xu hướng tăng tỷ lệ tử vong trong nhóm kiểm soát nhịp so với nhóm chứng (tỷ lệ nguy cơ 1.15, Cl 0.99-1.34,
|
P = 0.08), mặc dù điều này không do thúc đầy rối loạn nhịp. Bảng 30.9 liệt kê các biến cố bất lợi tiềm năng đối với rung nhĩ kịch phát và bảng 30.8 cho thấy phạm vi rối loạn nhịp thất được báo cáo trong y văn đối với các thuốc này.
Điều trị bằng thuốc chống rối loạn nhịp nên đưa ra đầu tiên cho từng bệnh nhân chủ yếu phụ thuộc vào sự hiện diện và loại bệnh tim nền. Do đó, flecainide, propafenone hoặc sotalol nên được chọn là thuốc điều trị ban đầu không có hoặc có bệnh tim tối thiểu (hình 30.12). Vì tỷ lệ tác dụng ngoài tim tương đối cao khi điều trị lâu dài, amiodarone thường được sử dụng như lựa chọn thứ 2, ngoại trừ bệnh nhân suy tim hoặc phì đại thất trái thì amiodarone được khuyến cáo là lựa chọn đầu tay. Bệnh nhân bị suy tim sung huyết thì đặc biệt nguy cơ cao mắc các biến cố thúc đầy rối loạn nhịp liên quan các thuốc chống rối loạn nhịp. Các thử nghiệm ngẫu nhiên đã chứng minh sự an toàn của amiodarone và dofetilide trên bệnh nhân suy tim [96, 97]. Tình huống đặc biệt của rung nhĩ đơn độc gây ra do mất cân bằng hệ thần kinh tự chủ cần phải có cách tiếp cận đặc biệt. Trên bệnh nhân rung nhĩ do thần kinh phế vị, disopyramide được xem là hấp dẫn vì đặc tính kháng cholinergic của nó. Trên bệnh nhân rung nhĩ đơn độc qua trung gian adrenergic, nên chọn một thuốc chẹn beta để điều trị.
Khi đơn trị liệu thất bại, có thể thử kết hợp các thuốc chống loạn nhịp. Sự kết hợp hữu ích gồm chẹn beta, sotalol hoặc amiodarone, công với một thuốc nhóm IC. Mặc khác, các bệnh nhân sử dụng các thuốc mức IA hoặc IC (hiếm khi là amiodarone) có thể bị nhịp thất cao khi phá cơn rung nhĩ hoặc cuồng nhĩ. Những thuốc này có thể làm tăng dẫn truyền nút nhĩ thất (AV) bằng cách kích thích kháng cholinergic và có thể chuyển rung nhĩ thành rối loạn nhịp có thể kiểm soát hơn, được gọi là “cuồng nhĩ mức IA hoặc IC”. Các thuốc chẹn beta và chẹn kênh canxi (hoặc digoxin) có thể thêm vào các thuốc nhóm IA hoặc IC để tránh tăng tần số thất. Tuy nhiên, cách tiếp cận này không được sự ủng hộ của các dữ liệu lâm sàng. Hơn thế nữa, trên bệnh nhân chuyển nhịp rung nhĩ thành cuồng nhĩ trong quá trình điều trị bằng thuốc chống rối loạn nhịp, cắt bỏ eo cuồng nhĩ (xem bên dưới) và tiếp tục điều trị bằng thuốc đã được báo cáo an toàn và hiệu quả để đạt được và duy trì nhịp xoang.
Kết hợp các thuốc không được phân loại như thuốc chống loạn nhịp có thể là cách tiếp cận khác để kiểm soát nhịp. Một phân tích nhỏ của nghiên cứu TRACE [98] nhận thấy giảm tỷ lệ mắc rung nhĩ trên bệnh nhân rối loạn chức năng thất trái sau nhồi máu cơ tim có uống trandolapril so với những bệnh nhân điều trị bằng giả dược. Kể từ đó, các nghiên cứu đã chứng minh rằng tái cấu trúc điện thế trong
rung nhĩ có thể được ngăn chặn bằng các thuốc đối kháng angiotensin II [99] cũng như với thuốc ức chế men chuyển angiotensin (ACE) [100, 101], chỉ ra hệ renin-angiotensin- aldosteron đóng vai trò như trung gian tái cấu trúc tâm nhĩ trong rung nhĩ. 2 thử nghiệm ngẫu nhiên gần đây cho thấy irbesartan [102] và enalapril [91] cùng với amiodarone hiệu quả hơn so với chỉ dùng amiodarone để dự phòng rung nhĩ tái phát ở bệnh nhân rung nhĩ dai dẳng.
Kiểm soát tần số thất
Bước đầu tiên điều trị rung nhĩ nói chung là kiểm soát tần số thất. Bệnh nhân diễn tiến nhịp nhanh thất trong cơn rung nhĩ có thể có triệu chứng cao do giảm cung lượng tim thứ phát vì đáp ứng thất nhanh. Điều này đặc biệt quan trọng trên bệnh nhân có bệnh tim nền hoặc bệnh nhân lớn tuổi.
Tần số thất trên bệnh nhân rung nhĩ phụ thuộc vào dẫn truyền nút nhĩ thất, do đó tương quan nghịch với thời gian trơ của nút nhĩ thất. Các thuốc kéo dài thời gian trơ hiệu quả của nút nhĩ thất kiểm soát đáp ứng tần số thất trên bệnh nhân rung nhĩ. ở phần lớn bệnh nhân có dẫn truyền nút nhĩ thất nguyên vẹn, cần thiết dùng một số thuốc kiểm soát tần số tim. Tuy nhiên, trên bệnh nhân có bệnh dẫn truyền, hầu hết gặp ở người lớn tuổi, có thể không cần dùng thuốc để làm chậm tần số thất.
Một số bệnh nhân cần kiểm soát tần số trong trường hợp khẩn cấp. Khi một bệnh cảnh lâm sàng như vậy xảy ra, nên cân nhắc cách tiếp cận sốc điện chuyển nhịp ngay lập tức. Trên từng bệnh nhân cụ thể, đánh giá mặc lợi
ích và tá hại của mỗi phương pháp điều trị sẽ cho biết quyết định kiểm soát tần số thất sử dụng các thuốc tác dụng nhanh hoặc chuyển nhịp ngay lập tức cho bệnh nhân. Như đề ở phần trước (xem bảng 30.3), sốc điện chuyển nhịp ngay lập tức được khuyến cáo trên bệnh nhân rung nhĩ cấp và đáp ứng thất nhanh liên quan nhồi máu cơ tim cấp, tụt huyết áp có triệu chứng, đau thắt ngực hoặc suy tim mà không đáp ứng nhanh với thuốc (khuyến cáo nhóm I, mức bằng chứng C, theo hướng dẫn AHA/ACC/ESC). Để nhanh chóng làm chậm dẫn truyền nhĩ thất, các thuốc tiêm tĩnh mạch như chẹn beta hoặc chẹn kênh canxi (verapamil, diltiazem) được khuyến cáo trong trường hợp không có dẫn truyền qua đường phụ và hết sức thận trọng ở bệnh nhân tụt huyết áp hoặc suy tim (khuyến cáo nhóm I, mức bằng chứng B, theo hướng dẫn AHA/ACC/ESC).
Trên bệnh nhân dẫn truyền thuận chiều qua đường phụ nhĩ thất (hội chứng Wolff-Parkinson-White) trong thời gian rung nhĩ, digoxin và chẹn kênh canxi là 2 thuốc chống chỉ định để kiểm soát tần số vì dẫn truyền thuận chiều qua đường phụ thì thích hợp khi dùng các thuốc này. Điều này có thể dẫn đến tần số thất tăng rõ rệt và thúc đầy quá trình thoái hóa thành rung thất. Sốc điện chuyển nhịp hoặc dùng các thuốc chống loạn nhịp típ 1 (disopyramide, procainamide, flecainide, propafenone) hoặc típ III (ibutilide hoặc amiodrone) có thể được sử dụng thay thế ở những bệnh nhân này (khuyến cáo nhóm IIb, mức bằng chứng C, theo hướng dẫn AHA/ACC/ESC). (Chú ý propafenone không được đề cập vì không có đường dùng qua tĩnh mạch ở Hoa Kỳ).
Tiêu chuẩn
Mức độ đầy đủ kiểm soát tần số trong thời gian rung nhĩ được đánh giá qua triệu chứng lâm sàng và đo tần số tim lúc nghỉ và lúc gắng sức (khuyến cáo nhóm I, mức bằng chứng C, AHA/ACC/ESC) vì tần số tăng lên quá mức có thể xảy ra lúc gắng sức nhẹ dù kiểm soát tốt tần số tim lúc nghỉ [103]. Tần số tim nói chung nên được cân nhắc kiểm soát khi đáp ứng thất dao động từ 60-80 lần/phút lúc nghỉ và 90-115 lần/phút lúc gắng sức trung bình [104]. Đo holter điện tâm đồ có thể giúp đánh giá kiểm soát tần số tim trong rung nhĩ [105].
Thuốc Digoxin
Mặc dù các hợp chất digitalis đã được dùng để điều trị rung nhĩ trong hơn 2 thế kỷ qua, các nghiên cứu gần đây cho thấy digoxin không có tác dụng chấm dứt rối loạn nhịp mà đôi khi còn gây hại. Tuy nhiên, digoxin có tác dụng điều nhịp âm tính và do đó có thể được cho để kiểm soát tần số tim trên bệnh nhân rung nhĩ.
Digoxin giúp kiểm soát các triệu chứng trên bệnh nhân rung nhĩ dai dẳng [106] nhưng thường không giảm các triệu chứng liên quan rung nhĩ kịch phát tái phát [107]. Do đó, digoxin có ít tác dụng lên chính nút nhĩ thất, như đã được chứng minh trên ghép tim bằng cách cắt đứt thần kinh và mạch máu từ tim ghép [108]. Hiện nay nhìn chung người ta chấp nhận các đặc tính đối giao cảm của digoxin chịu trách nhiệm cho cơ chế hoạt động gián tiếp. Điều này giải thích tỷ lệ kiểm soát nghèo nàn do digoxin gây ra trong quá trình kích thích giao cảm, đặc biệt khi gắng sức, cường giáp hoặc tăng thân nhiệt. Digoxin nên được xem là thuốc chẹn nút nhĩ thất yếu và không nên cho bằng đường uống như thuốc điều trị đầu tay để kiểm soát tần số thất trên bệnh nhân rung nhĩ, ngoại trừ bệnh nhân suy tim hoặc giới hạn vận động. Digoxin nên được dành riêng như điều trị hỗ trợ hiệu quả [109] khi điều trị đơn lẻ bằng thuốc khác không hiệu quả kiểm soát tần số thất. Không khuyến cáo sử dụng digoxin như thuốc duy nhất để kiểm soát tần số tim đáp ứng thất nhanh với rung nhĩ trên bệnh nhân rung nhĩ kịch phát (khuyến cáo nhóm III, mức bằng chứng B, theo khuyến cáo AHA/ACC/ESC) hoặc rung nhĩ dai dẳng (khuyến cáo nhóm II,b mức bằng chứng B, theo khuyến cáo AHA/ACC/ESC).
Khi sử dụng digoxin trong trường hợp cấp cứu, bác sĩ lâm sàng phải luôn nhớ mặc dù digoxin tiêm mạch có thể hiệu quả làm chậm tần số thất lúc nghỉ, có sự trì hoãn khoảng 60 phút trước khi khởi phát tác dụng điều trị hiệu quả trên hầu hết bệnh nhân, và hiệu quả cao nhất không đạt cho đến 6h. Với sự sẵn có của các thuốc khác hiệu quả hơn, digoxin không còn là lựa chọn đầu tay để điều trị rung nhĩ cấp, ngoại trừ bệnh nhân suy tim hoặc rối loạn chức năng thất trái.
Thuốc đối kháng Canxi
Nhóm thuốc chẹn kênh canxi có tác dụng dược lý đa dạng. Thuốc chẹn kênh canxi non-dihydropyridine verapamil và diltiazem là các thuốc dùng phổ biến nhất để kiểm soát tần số thất trên bệnh nhân rung nhĩ. Chúng kéo dài thời gian trơ hiệu quả của nút nhĩ thất, với cơ chế trực tiếp thông qua các kênh canxi loại L. Các thuốc đối kháng kênh canxi dihydropyridine không làm giảm nút nhĩ thất và có xu hướng tăng tần số thất khi rung nhĩ do kích hoạt phản xạ giao cảm thứ phát để làm giảm chức năng tâm thất trái và giãn mạch do các thuốc này gây ra.
Các thử nghiệm lâm sàng đã chứng minh verapamil và diltiazem giảm tần số tim lúc nghỉ và gắng sức đáng kể hơn so với giả dược. Điều này liên quan đến duy trì hoặc cải thiện khả năng gắng sức trên hầu hết bệnh nhân. Diltiazem và verapamil cũng hiệu quả hơn digoxin trong việc giảm tần số thất cả lúc nghỉ ngơi và gắng sức.
Trong bệnh cảnh cấp cứu, cả 2 thuốc đều hiệu quả nhanh để kiểm soát tần số thất, nhưng liều lập lại hoặc truyền liên tục thường cần thiết vì tác dụng phong tỏa nhĩ thất là thoáng qua khi sử dụng đường tiêm tĩnh mạch. Trên bệnh nhân rung nhĩ hoặc cuồng nhĩ và đáp ứng thất nhanh, ditiazem dùng dưới dạng bolus tĩnh mạch (0.25 mg/kg) làm giảm đáng kể tần số thất trung bình sau 5 phút (từ 150 xuống còn 111 nhịp/phút), trong khi đó giảm tần số tim khi dùng diogoxin 0.25 mg không có ý nghĩa thống kê cho đến 180 phút [113].
Verapamil và diltazem có tác dụng giảm co bóp cơ tim. Do đó, nên sử dụng thận trọng 2 thuốc này ở bệnh nhân suy tim và thậm chí cần trọng hơn khi tiêm tĩnh mạch. Tuy nhiên, 1 thử nghiệm ngẫu nhiên có đối chứng giả dược [114] đánh giá diltiazem tiêm tĩnh mạch điều trị rung nhĩ hoặc cuồng nhĩ liên quan nhịp thất nhanh trên bệnh nhân suy tim sung huyết trung bình đến nặng (NYHA III hoặc IV). Nhìn chung, 97% bệnh nhân đáp ứng điều trị với diltiazem tiêm tĩnh mạch, với thời gian trung bình để đáp ứng khoảng 5 phút từ lúc bắt đầu tiêm bolus 2 phút. Không có bệnh nhân nào làm trầm trọng thêm suy tim sung huyết do diltiazem tiêm tĩnh mạch. Do đó, Diltiazem tiêm tĩnh mạch an toàn và hiệu quả để kiểm soát nhịp nhanh thất trên bệnh nhân suy tim sung huyết trung bình đến nặng.
Các thuốc chẹn beta
Các thuốc chẹn beta kéo dài thời gian mà các tín hiệu truyền qua nút nhĩ thất trong tim không được kích hoạt bởi các tín hiệu điện khác bằng cách nhắm vào thụ thể beta – adrenergic và đối kháng với tác dụng tăng trương lực giao cảm. Đối với thuốc chẹn canxi, nhóm thuốc chẹn beta gồm một số thuốc có tác dụng dược lý khác nhau, như hoạt tính chủ vận từng phần và tính chọn lọc beta 1.
Các thử nghiệm ngẫu nhiên chỉ ra các thuốc chẹn beta làm giảm tần số tim cả lúc nghỉ và gắng sức tốt hơn nhiều so với giả dược, nhưng phạm vi hiệu quả thì theo từng thuốc cụ thể, như nadolol, atenolol và metoprolol là hiệu quả nhất [77, 111]. Các thuốc chẹn beta cũng hiệu quả hơn digoxin trong việc giảm tần số thất cả lúc nghỉ và gắng sức. Những kết quả đánh giá dung nạp khi gắng sức với thuốc chẹn beta vẫn chưa nhất quán.
Các thuốc chẹn beta tiêm tĩnh mạch như propanolol, atenolol hoặc esmolol có thể giúp kiểm soát tần đáp ứng thất đối với rung nhĩ. Các thuốc chẹn beta có thể đặc biệt hữu ích trong trường hợp kích thích giao cảm cao, như sau phẫu thuật tim hoặc ngoài tim. Trong số các thuốc chẹn beta có sẵn để dùng tiêm tĩnh mạch, esmolol có lợi ích là dễ chuẩn độ do thời gian bán thải huyết tương ngắn (9 phút).
Khi uống các thuốc chẹn beta, dùng 1 thuốc có thể thất bại kiểm soát tần số thất và kết hợp thuốc lại nâng cao hiệu quả điều trị. Trong các nghiên cứu đánh giá nhiều thuốc điều trị, kết hợp digoxin và chẹn beta hiệu quả hơn so với kết hợp digoxin và diltiazem [109].
Các thuốc chẹn beta nên dần dần đánh giá ban đầu trên bệnh nhân suy tim và được khuyến cáo trên bệnh nhân nhồi máu cơ tim cấp hoặc bệnh tim thiếu máu cục bộ. Mặc khác, chẹn kênh canxi được ưa chuộng hơn chẹn beta khi dùng lâu dài cho bệnh nhân hen phế quản hoặc trên bệnh nhân bệnh phổi tắc nghẽn mạn tính.
Các thuốc khác
Amiodarone hiệu quả để kiểm soát tần số thất trên bệnh nhân rung nhĩ. Do đó, amiodarone ức chế dẫn truyền nhĩ thất do đặc tính đối kháng giao cảm và canxi. Amiodarone là thuốc thay thế trên bệnh nhân rung nhĩ cấp khi các thuốc thông thường thất bại kiểm soát tần só that. Amiodarone tiêm tĩnh mạch hiệu quả và dung nạp tốt trên bệnh nhân suy tim. Liều nạp nhanh chóng amiodarone trong 30 phút truyền gần đây được đánh giá trong một thử nghiệm ngẫu nhiên [115] và kết quả là kiểm soát nhanh hơn tần số thất so với digoxin. Lợi ích của uống amiodarone với dẫn truyền nhĩ thất chưa được thực hiện trong các nghiên cứu tiền cứu và các tác dụng phụ liên quan việc sử dụng kéo dài.
Sotalol là thuốc chẹn beta chiếm ưu thế trong nhóm chống loạn nhịp nhóm III, cũng ức chế dẫn truyền nhĩ thất và cho thấy hiệu quả khi tiêm tĩnh mạch [115] hoặc uống [116]. Tuy nhiên, sotalol có các tác dụng phụ không thể chấp nhận và không được sử dụng để kiểm soát tần số thất trong thời gian dài.
Clonidine là thuốc hạ áp truyền thống, giảm dòng chảy giao cảm và kích thích dòng chảy phó giao cảm, kết quả kéo dài thời gian mà các tín hiệu truyền qua nút nhĩ thất trong tim không được kích hoạt bởi các tín hiệu điện khác của nút nhĩ thất. Clonidine làm giảm tần số thất 15-20% và có thể được quan tâm ở bệnh nhân rung nhĩ có tăng huyết áp. Khi uống clonidine, thay đổi tần số tim do clonidine có thể so sánh với digoxin tiêm tĩnh mạch [117].
Đặt máy tạo nhịp và khử rung tim
Dữ liệu thực nghiệm và lâm sàng gợi ý đặt máy tạo nhịp có thể dự phòng rung nhĩ [118-120] bằng cách giảm sự phân tán tái cực tâm nhĩ do nhịp tim chậm và ức chế quá tải tâm nhĩ do nhịp trên thất, do đó loại bỏ nguyên nhân gây rung nhĩ. Tạo nhịp liên tục tại các vị trí được chọn (xen kẽ, kép hoặc 2 bên) thay đổi mô hình kích hoạt tâm nhĩ, tăng tính đồng nhất của hoạt động điện nhĩ trái và phải trong dẫn truyền và kéo dài thời gian trơ tâm nhĩ, giảm sự phân tán của thời gian truyền qua nút nhĩ thất xảy ra khi co bóp sớm tâm nhĩ (PAC) hoặc với những thay đổi đột ngột trong tần số nhĩ và do đó dự phòng sự tiến triển tái nhập tâm nhĩ. Khả năng duy trì đồng bộ nhĩ thất và dự phòng sự tiến triển hở van 2 lá và/hoặc dẫn truyền nhĩ thất gây ra các thay đổi kéo dài trong quá trình tái cực tâm nhĩ cũng có thể làm giảm nguy cơ rung nhĩ tái phát.
Tạo nhịp để hỗ trọ tần số: VVIR và DDDR
Các phương thức tạo nhịp khác nhau đã được đánh giá liên quan khả năng dự phòng rung nhĩ. Tạo nhịp nhĩ cho thấy 1 vài lợi ích so với tạo nhịp thất đơn thuần trong việc giảm các cơn rung nhĩ và dữ liệu từ vài thử nghiệm đặt máy tạo nhịp ủng hộ sử dụng đặt máy tạo nhịp nhĩ hoặc 2 buồng hơn là đặt máy tạo nhịp thất để dự phòng rung nhĩ trên bệnh nhân có chỉ định đặt máy tạo nhịp [121-125]. Người ta thấy có phân nhóm nhất định hưởng lợi từ tạo nhịp sinh lý để phòng ngừa rung nhĩ: những bệnh nhân bị rối loạn chức năng nút xoang, thường xuyên được tạo nhịp trong tâm thất và trước đây không có bất kỳ tiền sử rung nhĩ [119].
Đặt máy nhiều vị trí hoặc vị trí thay thế
Các nghiên cứu thực nghiệm và lâm sàng đã chứng minh tạo nhịp qua vách ngăn, qua 2 vị trí hoặc qua 2 tâm nhĩ rút ngắn tổng thời gian kích hoạt tâm nhĩ và giảm sự phân tán tổng thể của khả năng trơ tâm nhĩ [126-129]. Một vài thử nghiệm lâm sàng đã đánh giá hiệu quả của các vị trí đặt máy tạo nhịp nhĩ được lựa chọn như một chỉ định (bó Bachmann, vách liên nhĩ). Tuy nhiên, thử nghiệm ngẫu nhiên lớn nhất của đặt máy tạo nhịp tâm nhĩ so với đặt ở vách ngăn (ASPECT) [130] đã không thể chứng minh được giảm tần suất rung nhĩ và gánh nặng theo trong thời gian theo dõi ngắn.
Đặt máy nhiều vị trí đã cho thấy hiệu quả trong việc giảm rung nhĩ xuất hiện ở một số bệnh nhân. Một vài kỹ thuật đã được sử dụng, bao gồm đặt máy 2 vị trí trong tâm nhĩ phải hoặc đặt trong tâm nhĩ phải và xoang vành theo kiểu 2 nhĩ [131-135]. Trong các nghiên cứu này, phần lớn bệnh nhân bị rối loạn chức năng nút xoang. Trong thử nghiệm DAPPAF trên bệnh nhân điều trị bằng thuốc chống rối loạn nhịp, đặt máy tạo nhịp nhĩ phải kép làm tăng khả năng sống không có triệu chứng rung nhĩ so với hỗ trợ tạo nhịp hoặc đặt máy tạo nhịp nhĩ phải cao, ủng hộ sử dụng cách tiếp cận kết hợp nhiều phương pháp để kiểm soát nhịp [131].
Các kết quả trên bệnh nhân không có rối loạn chức năng nút xoang đã được báo cáo nhưng ít khuyến khích [132]. Trên bệnh nhân bị trễ nhĩ trái và rung nhĩ, nghiên cứu SYNBIAPACE đã chứng minh không giảm rung nhĩ nhất quán trong thời gian theo dõi lâu dài giữa tạo nhịp nhĩ phải, tạo nhịp theo yêu cầu 40 nhịp/phút hoặc tạo nhịp 2 nhĩ [136]. Mặc dù các nghiên cứu sẵn có gợi ý đặt máy tạo nhịp 2 nhĩ và nhiều vị trí có thể hiệu quả trên một số bệnh nhân để dự phòng thứ phát rung nhĩ, không có các dự đoán rõ ràng nhóm bệnh nhân nào sẽ nhận lợi ích nhiều nhất.
Sơ đồ dự phòng/đặt máy chống loạn nhịp nhanh
Một số sơ đồ tạo nhịp chọn lọc được thiết lập để dự phòng rung nhĩ [137]. Các cơ chế tiềm năng của những sơ đồ này gồm ngăn ngừa tạm dừng sau PAC, tạo nhịp nhĩ liên tục, chấm dứt cơn nhịp nhanh sau PAC và chấm dứt cơn nhịp nhanh thoáng qua sau rung nhĩ. Các nghiên cứu lâm sàng [131, 138-140] gợi ý các sơ đồ dự phòng rung nhĩ có lợi ích gia tăng từ khiêm tốn đến tối thiểu để dự phòng rung nhĩ. Trong các nghiên cứu này, người ta quan sát thấy lợi ích lớn trên bệnh nhân dùng thuốc chống loạn nhịp đồng thời, gợi ý nâng cao sự hiệu quả khi tạo nhịp được xem như 1 cách tiếp cận “kết hợp”. Về vấn đề này, các sơ đồ sau có thể mang lại lợi ích tiềm năng trên bệnh nhân cần đặt máy tạo nhịp hoặc thiết bị cấy dưới da trong các chỉ định không phải rung nhĩ [118, 119].
Trong một số trường hợp, rung nhĩ có thể được kiểm soát bằng các thiết bị chống nhịp nhanh thông qua sử dụng đặt máy tạo nhịp chống nhịp tim nhanh, tạo nhịp nhĩ tần số cao hoặc khử rung nhĩ. Cách tiếp cận này dựa trên bối cảnh ngay cả rung nhĩ có thể được tổ chức một cách hiệu quả ngay từ đầu để cho phép can thiệp tạo nhịp và chấm dứt rối loạn nhịp tim. Người ta cũng đưa ra giả thuyết chấm dứt nhanh nhĩ hoặc cuồng nhĩ sẽ dự phòng sự tiến triển rung nhĩ và giảm gánh nặng rung nhĩ tổng thể. Mặc dù tạo nhịp chống nhanh nhĩ và tạo nhịp liên tục tần số cao cơ hiệu quả hơn 50% các trường hợp, nhưng không giảm tấn suất rung nhĩ cũng như gánh nặng rung nhĩ đã được quan sát 1 cách nhất quán [141-145].
Tóm lại, mặc dù tạo nhịp nhĩ liên quan với nguy cơ thấp rung nhĩ và đột quỵ hơn tạo nhịp thất trên bệnh nhân cần đặt máy tạo nhịp đối với chứng rối loạn nhịp chậm, sử dụng tạo nhịp như phương pháp điều trị chính yếu để dự phòng rung nhĩ tái phát vẫn chưa được xác nhận.
Máy khử rung nhĩ (ghép máy chuyển nhịp và máy khử rung)
Thử nghiệm lâm sàng ban đầu với máy khử rung nhĩ “độc lập” gợi ý khử rung nhĩ là an toàn và hiệu quả.
Thế hệ đầu tiên của máy khử rung nhĩ được theo sau bởi máy khử rung nhĩ thất 2 buồng có sẵn. Máy khử rung nhĩ hiện có hiệu quả cao khôi phục lại nhịp xoang trên hầu hết bệnh nhân. Có thể đạt được nhịp xoang mà không có nguy cơ rung thất. Điểm hạn chế chính của kỹ thuật này là sốc điện với năng lượng tương đối thấp sẽ gây đau không thể chịu đựng nếu làm nhiều lần. Tuy nhiên, có thể tần số cơn rung nhĩ giảm trên bệnh nhân được khử rung kịp thời. Điều trị này có lợi ích nhất khi được sử dụng như một thành phần điều trị kết hợp trong rung nhĩ. Các ứng viên lý tưởng dường như là những bệnh nhân rung nhĩ hoặc có nguy cơ rung nhĩ mà có chỉ định khử rung thất hoặc đặt máy tạo nhịp 2 buồng [146, 147]. Tuy nhiên, không có nghiên cứu có đối chứng so sánh hiệu quả, sống còn, chất lượng cuộc sống hoặc chi phí trên bệnh nhân cấy ghép máy khử rung nhĩ so với các phương pháp điều trị khác.
Điều trị phối hợp (Hybrid)
Hiện nay, mối quan tâm quan trọng là điều trị kết hợp (hydrid), xuất phát từ sự hiểu biết các cơ chế khác nhau chịu trách nhiệm bắt đầu gây ra và duy trì rung nhĩ. Thuật ngữ “hydrid” ám chỉ chất lượng điều trị khác nhau về cơ bản sẽ cùng nhau kết hợp thành điều trị bổ trợ nhau. Ví dụ, bổ sung 2 hoặc nhiều cách chống loạn nhịp độc lập (giảm PAC nhờ máy tạo nhịp và thay đổi chất nền của thuốc chống loạn nhịp), trung hòa tác dụng chống loạn nhịp của 1 phương pháp này bằng 1 phương pháp khác (máy tạo nhịp ngăn ngừa nhịp tim chậm liên quan thuốc chống loạn nhịp) và tạo điều kiện thuận lợi cho tác dụng chống loạn nhịp của 1 phương pháp này bằng 1 phương pháp khác (quản lý rung nhĩ bằng các thuốc chống loạn nhịp để tăng khả năng thành công của tạo nhịp chống loạn nhịp). Mặc dù rất thú vị, đây vẫn là lý thuyết chưa được đánh giá 1 cách toàn diện [118, 131, 194].
Đốt điện qua catheter/sửa đổi nút nhĩ thát để kiểm soát tần số tim
Có bằng chứng bệnh nhân rung nhĩ có thể được lợi từ việc kiểm soát tần số thất và tính đều đặn của nhịp. Do đó, tạo nhịp sau cắt bỏ bộ nối nhĩ thất gây block tim (cắt bỏ và tạo nhịp) là chiến lược hữu ích để bệnh nhân rung nhĩ có triệu chứng và dai dẳng (hình 30.13). Các lợi ích của thủ thuật này đã được chứng minh trong nhiều thử nghiệm có nhóm chứng và không nhóm chứng [148]. Cắt bỏ nút nhĩ thất đặc biệt có lợi khi tần số thất cao quá mức gây suy giảm chức năng tâm thu thất qua trung gian nhịp tim nhanh mặc dù đã điều trị phù hợp. Chiến lược “cắt bỏ và tạo nhịp” đã chứng minh cải thiện dung nạp khi gắng sức, chức năng tim, sử dụng dịch vụ chăm sóc sức khỏe và chất lượng cuộc sống. Tính an toàn của phương pháp này đã được xây dựng và trong một phân tích tổng hợp về nguy cơ đột tử và tỷ lệ tử vong chung lần lượt là 2% và 6% trong 1 năm, các con số tương tự như tỷ lệ tử vong quan sát được khi điều trị rung nhĩ [149, 150].
Dĩ nhiên, cắt bỏ nút nhĩ thất và tạo nhịp có nhiều điểm bất lợi: gây ra block nhĩ thất không hồi phục, mất đồng bộ nhĩ thất (đây là vấn đề quan trọng trên bệnh nhân phụ thuộc nhiều nhất vào đồng bộ nhĩ thất như các bệnh cơ tim phì đại hoặc hạn chế), không giảm bớt nhu cầu dùng kháng đông và ưu tiên sau này sử dụng điều trị dùng thuốc hoặc không dùng thuốc mới hơn và hiệu quả hơn.
Điều chỉnh nút nhĩ thất bằng cách loại bỏ các đầu vào tâm nhĩ sau để vào nút nhĩ thất được đề xuất như phương pháp giảm tần số thất trong rung nhĩ, tránh block nhĩ thất hoàn toàn và đặt máy tạo nhịp vĩnh viễn (hình 30.14). Tuy nhiên, phương pháp này ít được chấp nhận rộng rãi do tỷ lệ thành công thấp, nguy cơ vô tình gây block nhĩ thất và các triệu chứng dai dẳng do nhịp tim đập không đều trong rung nhĩ [151-153].
Cắt đốt rung nhĩ
Bằng chứng mới nổi lên gần đây gợi ý một lợi ích đáng kinh ngạc để duy trì nhịp xoang trên bệnh nhân rung nhĩ [154]. Mặc dù các thuốc chống loạn nhịp là phương pháp chính để đạt và duy trì nhịp xoang trên bệnh nhân rung nhĩ, nhưng hiệu quả bị hạn chế và khả năng gây các tác dụng phụ đáng kể, làm các nhà nghiên cứu hướng sự quan tâm đến các chiến lược không dùng thuốc để duy trì nhịp xoang [43, 155, 156].
Cắt đốt qua catheter
Trong 10 năm kể từ khi mô tả ban đầu thành công khi cắt đốt qua catheter như phương pháp để duy trì nhịp xoang, các kỹ thuật của chúng tôi vẫn tiếp tục phát triển [157, 158]. Nhiều chiến lược và công nghệ khác nhau đã được nghiên cứu hàng năm đạt được 1 số thành công, tuy nhiên, hầu hết các nhóm hiện nay tập trung vào thực hiện các vết rạch xung quanh tĩnh mạch phổi, ít nhất đối với rung nhĩ kịch phát.
Vai trò của tĩnh mạch phổi trong trung nhĩ
Hiện nay người ta nhận ra rung nhĩ trên lâm sàng là kết quả từ sự tương tác phức tạp của các yếu tố kích thích và chất nền làm rung tâm nhĩ [159]. Trong khi một số cấu trúc được xem là nguồn khởi phát tiềm năng, người ta nhận thấy các tĩnh mạch phổi chiếm ưu thế hơn cả, bằng sự phóng điện khu trú từ hệ cơ tĩnh mạch phổi có liên quan khởi phát 60-94% rung nhĩ kịch phát [160-162]. Mặc dù mục đích ban đầu của các thủ thuật này loại bỏ các yếu tố kích hoạt khu trú bằng cách cắt bỏ cục bộ, nhưng khi nhận ra nhiều vị trí trong một tĩnh mạch phổi và các tĩnh mạch phổi có thể gây rối loạn nhịp tim đã đưa đến chiến lược cách ly điện của tất cả tĩnh mạch phổi để dự phòng bất kỳ sự tương tác của các yếu tố kích thích này với chất nền tâm nhĩ.
Trong một nhóm nhỏ bệnh nhân, các yếu tố kích thích cục bộ từ các tĩnh mạch phổi cũng có thể đóng vai trò thúc đầy rung tâm nhĩ [160]. Trên những bệnh nhân có các dạng tĩnh mạch phổi ở dạng kích thích hoặc chất nền duy trì rung nhĩ và cô lập tĩnh mạch phổi (PVI) có hiệu quả cao hơn cả. Tuy nhiên, vai trò của các tĩnh mạch phổi vượt xa các yếu tố khởi phát ban đầu. Hiện nay có bằng chứng rõ ràng gợi ý các tĩnh mạch trên thực tế đóng vai trò quan trọng duy trì rung nhĩ, khiến cho phân loại các yếu tố kích hoạt hoặc chất nền trở nên lỗi thời. Vai trò này của các tĩnh mạch phổi rõ ràng được chứng minh bằng cách quan sát trên bệnh nhân rung nhĩ kịch phát, tiến hành cô lập điện tĩnh mạch phổi (PVI) khi rung nhĩ, kéo dài dần độ dài của chu kỳ rung nhĩ (hoặc làm chậm quá trình rung nhĩ) mà đỉnh điểm là chấm dứt rung nhĩ lên đến 75% các trường hợp [163]. Hơn thế nữa, sau khi PVI tất cả các tĩnh mạch, 54% bệnh nhân không còn chịu đựng các triệu chứng kéo dài do rung nhĩ, điều này gợi ý có tỷ lệ đáng kể bệnh nhân rung nhĩ kịch phát do các tĩnh mạch phổi tạo chất nền gây rung nhĩ.
Vì sao các cấu trúc này lại gây loạn nhịp tim là 1 lĩnh vực được nghiên cứu mạnh mẽ. Các nghiên cứu giải phẫu học đã chứng minh sự mở rộng phức tạp và thay đổi khối cơ tâm nhĩ vào các tĩnh mạch phổi, với các yếu tố giải phẫu quyết định này tạo ra môi trường ưu tiên dẫn truyền, chặn dẫn truyền 1 chiều và vào lại [165-168]. Các nghiên cứu lâm sàng đã chứng minh tĩnh mạch phổi trên bệnh nhân rung nhĩ có đặc tính điện sinh lý đặc biệt đặc trưng bởi thời gian trơ ngắn và tính dị hướng lớn hơn so với bệnh nhân không rung nhĩ [169].
Do đó, các đặc tính này có khả năng duy trì hoạt động tần số cao [170, 171]. Như vây, cắt bỏ những cấu trúc gây rối loạn nhịp này là một phần thiết yếu trong chiến lược cắt bỏ trong rung nhĩ.
Có cần ngắt điện các tĩnh mạch phổi (PV) không?
Hiện nay, mặc dù hầu hết các nhóm đều đồng ý là các thương tổn xung quanh tĩnh mạch phổi có thể điều trị khỏi trên phần lớn bệnh nhân rung nhĩ kịch phát, vẫn còn tranh cãi liệu ngắt hoàn toàn dòng điện có tốt hơn ngắt kết nối không hoàn toàn? Ngoài ra, các báo cáo từ nhiều nhóm ủng hộ sử dụng phương pháp giải phẫu thuần túy đã công nhận có tỷ lệ đáng kể rối loạn nhịp có tổ chức xảy ra sau quá trình cắt bỏ. Do đó, Pappone và cộng sự thực hiện một nghiên cứu gần đây [172] báo cáo các tổn thương bao quanh không hoàn toàn (“khoảng trống”) là yếu tố dự đoán cao nhất cho sự tiến triển tiếp theo của rối loạn nhịp có tổ chức. Phát hiện này góp phần ủng hộ các tổn thương hoàn toàn, với các tổn thương hoàn toàn rất quan trọng để dự phòng tái lập trên phạm vi lớn, ngược lại, các thương tổn không hoàn toàn thúc đầy xuất hiện rối loạn nhịp nhĩ.
Một cách tiếp cận theo giải phẫu được ủng hộ (hình 30.15), theo đó các tổn thương vòng tròn được tiến hành mà không cần đánh giá điện thế tĩnh mạch phổi đoạn xa [173, 174]. Sử dụng kỹ thuật này có đến 45% các tĩnh mạch phổi không bị cô lập, với dẫn truyền liên tục của nhĩ trái – tĩnh mạch phổi và do đó vẫn còn khả năng rối loạn nhịp [175]. Mặc dù có bằng chứng chắc chắn chứng minh tính gây rối loạn nhịp của tĩnh mạch phổi và hậu quả tiềm năng của sự tương tác giữa tĩnh mạch phổi và nhĩ trái trong các nghiên cứu so sánh kết cục cô lập tĩnh mạch phổi (PVI) hoàn toàn so với không hoàn toàn, không có kết luận cụ thể nào về sự cần thiết của PVI trong giai đoạn này. Tuy nhiên, về mặc lý thuyết, trong các tổn thương không hoàn toàn có thể dẫn đến 1 loạt các tương tác PV-nhĩ trái, người ta có thể lập luận kết quả sự cô lập hoàn toàn có thể loại bỏ tất cả các tương tác đó, do đó, PVI ít nhất phải mang lại hiệu quả tương tự nếu không muốn nói là vượt trội so với cách ly không hoàn toàn.
Các bằng chứng thêm về nhu cầu PVI được chứng minh trong các nghiên cứu đánh giá rung nhĩ tái phát sau cắt bỏ. Các nghiên cứu này được quan sát thấy đại đa số bệnh nhân tái phát rung nhĩ biểu hiện tái dẫn truyền tĩnh mạch phổi. Lặp lại PVI trên những bệnh nhân này có liên quan loại bỏ tất cả rung nhĩ trên 90% bệnh nhân [176, 177]. Dữ liệu này cho thấy sự tương tác giữa tâm nhĩ trái và PV còn sót lại trong tiến triển rối loạn nhịp tim trên lâm sàng và làm nổi bật tầm quan trọng phải đạt cô lập hoàn toàn.
Các kỹ thuật cô lập tĩnh mạch phổi (PV)
Ánh xạ theo chu kỳ cho phép xác định trình tự phân bố và kích hoạt theo chu kỳ của tĩnh mạch phổi, định vị vị trí và mức độ của cơ vân cục bộ kết nối điện tĩnh mạch phổi đến nhĩ trái (hình 30.16) [178].
Hình 30.15 Các cách tiếp cận khác nhau để cắt bỏ tĩnh mạch phổi (PV) được đề xuất. (A) Sơ đồ giải phẫu cho thấy vòng bao quanh tĩnh mạch phổi 4×4, 2×2 hoặc từng cái một. Thủ thuật thường dùng nhất là cắt bỏ PV cùng bên bằng cách sử dụng các tổn thương tuyến tính được đặt ít nhất 1cm từ lỗ PV, trong tâm nhĩ trái. Vị trí tương tự của các tổn thương có thể được dùng với cách tiếp cận sinh lý điện học (B), sự khác biệt lớn nhất là phong tỏa PV được xác định bằng ánh xạ vòng tròn (xem hình 30.16) được dùng như kết thúc rõ ràng để tối đa hóa hiệu quả thủ thuật. Nên chú ý khi tiến hành cắt bỏ dọc theo mặt trước trái của tĩnh mạch phổi, xâm nhập vào PV thường được yêu cầu để đạt được sự ổn định của catheter; trong ca này tiến hành cắt bỏ với công suất giảm và được giới hạn bằng cách nhắm trúng đích các kết nối tâm nhĩ trái – PV quan trọng. AP, trước sau; PA, sau trước; RF, tần số vô tuyến; LIPV, tĩnh mạch phổi dưới trái; LSPV, tĩnh mạch phổi trên trái; RIPV, tĩnh mạch phổi dưới phải; RSPV, tĩnh mạch phổi trên phải.
Hình 30.16 Có thể dễ dàng cách ly tĩnh mạch phổi (PV) bằng cách sử dụng catheter ánh xạ vòng tròn. Trong ví dụ này, catheter ánh xạ được đưa vào tĩnh mạch phổi trên trái (LSPV)
- Cho thấy điện thế tâm nhĩ và tĩnh mạch xếp chồng lên nhau. Bằng cách tạo nhịp từ xoang vành (CS), điện thế tĩnh mạch (PVP) theo điên thế tâm nhĩ trường xa
- Sau khi cắt bỏ bằng tần số vô tuyến mô tâm nhĩ xung quanh tĩnh mạch, sự cô lập hoàn toàn được chứng minh bằng sự biến mất của điện cực tĩnh mạch với sự tồn tại của các điện thế tâm nhĩ trường xa.
Bằng cách cắt bỏ tuần tự các vị trí hoạt động sớm nhất, các tĩnh mạch phổi có thể được cô lập điện thế khỏi nhĩ trái. Mặc dù người ta mô tả quá trình này phân đoạn, để nhấn mạnh nhu cầu áp dụng tần số vô tuyến dài hơn tại các vị trí quan trọng làm thay đổi kích hoạt tĩnh mạch phổi, cắt bỏ được thực hiện hầu hết theo chu vi bằng cách di chuyển theo xung quanh tĩnh mạch phổi. Quá trình cắt bỏ có thể bắt đầu ở các tĩnh mạch phổi trái hoặc phảivà thực hiện riêng lẻ hoặc theo khối khi 2 hoặc 3 lỗ tĩnh mạch phổi kế hợp nhau (hình 30.15B) [171, 178, 179].
Hầu hết các tác giả đồng ý các tổn thương dùng để cô lập các tĩnh mạch phổi nên đặt trong tâm nhĩ hoặc càng gần càng tốt hơn là các tĩnh mạch phổi đoạn xa. Chiến lược này không chỉ giảm tỷ lệ hẹp tĩnh mạch phổi mà còn cải thiện hiệu quả bằng cách loại bỏ ổ hoạt động ở đoạn gần của chất xơ gây rối loạn nhịp. Quá trình cắt bỏ thường được bắt đầu tại thành sau và sau đó tiếp tục đi quanh chu vi tĩnh mạch. Tuy nhiên, nên chú ý khi quá trình cắt bỏ thực hiện dọc theo mặt trước và mặt dưới các tĩnh mạch phổi, xâm lấn vào tĩnh mạch phổi thường yêu cầu để ổn định catheter; quá trình cắt bỏ trong trường hợp này được thực hiện với công suất giảm và bị giới hạn bằng cách nhắm mục tiêu các kết nối tĩnh mạch phổi – tâm nhĩ quan trọng.
Điều quan trọng cần lưu ý là sử dụng catheter ánh xạ hình tròn không đồng nghĩa với quá trình cắt bỏ các tổn thương được thực hiện tại lỗ tĩnh mạch phổi. Khoảng cách lớn hơn 1 hoặc 1.5 cm giữa các catheter thường được quan sát khi quá trình cắt bỏ được thực hiện ở tâm nhĩ. Do đó, catheter ánh xạ hình tròn được sử dụng để cung cấp một điểm cuối rõ ràng để cô lập hoàn toàn, thủ thuật thành công khi bao quanh các thương tổn rộng xung quanh các tĩnh mạch phổi từ bên trong chính tâm nhĩ, theo đề xuất của Marouche cùng cộng sự [180] và nghiên cứu gần đây của Ouyang cùng cộng sự.
Chỉnh sửa chất xơ (Substrate modification)
Mặc dù đã loại bỏ các tác nhân ban đầu gây rung nhĩ, hầu hết bệnh nhân mắc rung nhĩ dai dẳng hoặc vĩnh viễn và khoảng 20-40% số bệnh nhân có rung nhĩ kịch phát đều có các cơn rung nhĩ tiếp theo [181-183]. Trong số bệnh nhân này, nâng cao kết cục quá trình cắt bỏ phụ thuộc vào chỉnh sửa chất xơ bổ sung. Cơ sở định nghĩa chỉnh sửa chất xơ bằng cách ngăn tâm nhĩ dựa trên giả thuyết nhiều sóng nhỏ wavelet của Moe cùng các đồng nghiệp, gợi ý rung nhĩ được duy trì nhờ nhiều sóng con lan truyền đồng thời trong tâm nhĩ và một khối lượng tối thiểu của cơ tim liên tục dẫn truyền điện phải có mặt để duy trì các sóng nhỏ wavelet khi vào [184]. Hơn nữa gần đây, các kỹ thuật khác về chỉnh sửa chất xơ đã được đánh giá [185, 186]. Nademanee cùng cộng sự [186] đã đệ trình quá trình cắt bỏ các điện đồ phân đoạn phức tạp, với giả thuyết cho rằng chúng tạo thành các điểm trụ cho phản ứng xảy ra lại gây rung nhĩ . Pappone cùng cộng sự [185] và gần đây hơn là nhóm từ Okahoma (Viện nghiên cứu rối loạn nhịp tim) đã mô tả vai trò tiềm năng của đám rối hạch và hiệu quả cắt bỏ tần số vô tuyến tại các vị trí nhĩ khi đáp ứng phế vị được quan sát sau khi kích thích tại chỗ. Tuy nhiên, kết quả lâu dài của thủ thuật này bị giới hạn do các hạch này vẫn chưa có sẵn.
Mặc dù các catheter đặc biệt sử dụng trong quá trình cắt bỏ tuyến tính vẫn còn đang phát triển, các catheter thông thường dùng để đánh giá vai trò của quá trình cắt bỏ tâm nhĩ tuyến tính, gần đây đã được nâng cao bằng cách đưa vào các đầu dò lớn hoặc hủy hoại dẫn lưu bằng nước.
Hình 30.17 Tiến hành cắt bỏ eo van 2 bằng cách ổn định catheter (tốt nhất là catheter có lỗ tưới nước) thông qua một ống dài, kéo dài đường cắt bỏ từ vòng van 2 lá đến lỗ thông tĩnh mạch phổi trái (LPV). (A) Tạo nhịp khác nhau (từ CS) được sử dụng để loại trừ dẫn truyền chậm thông qua đường rạch. Tạo nhịp ngắn hơn đến điện thế tâm nhĩ được ghi lại trong quá trình tạo nhịp từ CS đoạn gần (cực 3-4) trong khi tạo nhịp từ CS đoạn xa (B) liên quan độ trễ lâu hơn do đường đi kích hoạt đi từ vách ngăn của đường bao quanh tâm nhĩ vòng van 2 lá đến mép bên của đường dài hơn. Hoạt động sớm nhất được ghi lại tại vị trí tạo nhịp và sau đó di chyển xung quanh vòng van 2 lá để đi đến tâm nhĩ trái phía trước. Hoạt động mới nhất hiển thị bằng màu tím được ghi lại trong vách ngăn của đường block eo 2 lá. Việc đạt được dòng block hòan chỉnh là rất cần thiết để ngăn chặn sự vào lại liên tục trên phạm vi lớn, thường lan truyền qua các dòng block không hoàn chỉnh. CS, xoang vành; RF, tần số vô tuyến.
Qúa trình cắt bỏ tuyến tính được thực hiện giữa các trở lực điện giải phẫu hoặc chức năng để cắt ngang các vùng này nên ngăn được chúng xâm nhập lại. Điều quan trọng của thủ thuật này là quá trình cắt bỏ đòi hỏi phải kết hợp và xuyên thành để đạt thương tổn hoàn toàn và nâng cao kết cục tốt hơn. Đây có thể là thách thức, với sự gia tăng nguy cơ thủ thuật (đặc biệt chèn ép tim và đột quỵ) và có thể gây rối loạn nhịp trong bệnh cảnh các khoảng trống không hoàn toàn và hồi phục [187-192].
Một loạt cách khác nhau được nghiên cứu, tuy nhiên để dự đoán đường nào phù hợp hơn trên bệnh nhân nhất định rất khó nắm bắt. Các thương tổn tuyến tính ở trần nhĩ trái liên kết tĩnh mạch phổi trên tương đối dễ làm, nhưng khi đã chứng minh block hoàn toàn thì không phải lúc nào cũng dễ dàng và yêu cầu một catheter thứ 2 nhằm tạo nhịp từ phần phụ bên trái. Gần đây, khi một đường phía sau đã được tiến hành bằng cách sử dụng năng lượng cao như 1 phần của chiến lược cắt bỏ giải phẫu, một số bệnh nhân bị lỗ rò tâm nhĩ – thực quản [191]. Các thương tổn liên kết mặt trước của vòng van 2 lá đến trần tâm nhĩ hoặc với tĩnh mạch phổi trên phải để cắt ngang phần trước tâm nhĩ làm gián đoạn hoạt hóa nút xoang, kết quả làm chậm kích hoạt tâm nhĩ trái bên và có thể gây hậu quả xấu đối với chức năng cơ học tâm nhĩ [189].
Cắt bỏ eo van 2 lá (hình 30.17), kết nối vòng van 2 lá bên với tĩnh mạch phổi dưới trái, về lý thuyết mang lại một số lợi ích cho các tổn thương tâm nhĩ trái khác [190]. Đường này ngắn nhưng tạo ra 1 tổn thương dài tiếp giáp với các tĩnh mạch phổi bị cắt bỏ và không cản trở hoạt động nhịp xoang bình thường của tâm nhĩ. Ngoài ra, do gần với xoang vành cho phép định vị các catheter ở bên của đường đi để đánh giá tính toàn vẹn của đường đi.
Chapter 30 Tuy nhiên, bat chap các đặc điểm này, quá trình cắt bỏ tại vị trí yêu cầu 20-25 phút áp dụng tần số vô tuyến, 68% yêu cầu cắt bỏ trong xoang vành [190].
Khi được thực hiện bằng PVI, các thương tổn tuyến tính này cải thiện tỷ lệ thành công lên 10-20% trong rung nhĩ kịch phát và 30-50% trong rung nhĩ dai dẳng hoặc vĩnh viễn. Mặc dù không có sự nhất trí về đạt được block hoàn toàn có phải là mong muốn hay không, các tổn thương không hoàn toàn thường liên quan đến tái lập trong phạm vi lớn, thường có nhiều triệu chứng hơn.
Các biến chứng
Mặc dù cải thiện đáng kể trong những năm gần đây, cắt bỏ rung nhĩ qua catheter vẫn còn liên quan các biến chứng đáng kể. Hầu hết biến chứng đáng lo ngại nhất là hẹp tĩnh mạch phổi [193]. Hiện nay tỷ lệ mắc hẹp tĩnh mạch phổi trên phim mạch máu (giảm >50% đường kính tĩnh mạch phổi) là < 2%, với hầu hết bệnh nhân không có triệu chứng. Tỷ lệ mắc này giảm đáng kể nếu cắt bỏ lỗ thông bằng năng lượng thấp và kinh nghiệm của bác sĩ phẫu thuật. Quan trọng là hiện nay không có hệ thống định vị nào có thể loại bỏ hoàn toàn nguy cơ. Hơn 2000 bệnh nhân được cắt bỏ tĩnh mạch phổi cho đến nay, chúng tôi đã quan sát các trường hợp hẹp tĩnh mạch phổi nặng (>70%) chỉ 4 bệnh nhân, những bệnh nhân còn lại sau đó cần phải nong tĩnh mạch phổi hoặc đặt stent. Ngoài ra, 5 trong số 2000 bệnh nhân này tiến triển thành tổn thương thần kinh hoành bên phải và hồi phục hoàn toàn.
Cắt bỏ bất kỳ vị trí nào trong tâm nhĩ có thể làm gây bất thường dẫn truyền sau đó có thể vào lại. Chỉ sau khi cô lập tĩnh mạch phổi, chúng tôi quan sát khoảng 12% bệnh nhân có khả năng vào lại đường đi lớn và 5% có khả năng vào lại đường đi lớn tự phát [194]. Ánh xạ và cắt bỏ đã chứng minh phần lớn trong số này sử dụng vùng cắt bỏ làm một điểm tắc nghẽn trung tâm, dẫn đến 1 trong 2 vào lại quanh van 2 lá hoặc quanh tĩnh mạch phổi, trường hợp thứ 2 phổ biến hơn trên bệnh nhân có tâm nhĩ lớn [177, 194].
Tuy nhiên, có một nhóm nhỏ rối loạn nhịp sử dụng thương tổn cắt bỏ trước đó hoặc các vùng bất thường dẫn truyền trong tâm nhĩ để hỗ trợ vòng vào lại [195]. Khi cách tiếp cận giải phẫu bao quanh tĩnh mạch phổi đã được sử dụng, các báo cáo tỷ lệ mắc rối loạn nhịp vào lại ngày càng nhiều hơn, với một số nhóm báo cáo rối loạn nhịp tự phát lên đến 27%, có lẽ do cắt bỏ phần lớn tâm nhĩ và cắt bỏ không hoàn toàn [196-198].
Gần đây, một số lượng lớn các trường hợp rò nhĩ – thực quản được báo cáo, liên quan đến kết cục tử vong nhiều bệnh nhân [191]. Đến nay, biến chứng này vẫn được quan sát trên bệnh nhân cắt bỏ hoàn toàn về mặt giải phẫu và gần như chắc chắn là kết quả của thời gian cắt bỏ lớn cần phải có năng lượng cao hơn đi dọc theo tâm nhĩ trái sau.
Các biến chứng khác đã được ghi nhận gồm chèn ép tim (0-4%), các biến cố thuyên tắc (0-1%) và chấn thương bẹn (<5%)
Chỉ định
Đối với rung nhĩ kịch phát, phải có đủ cơ sở để chứng minh một thủ thuật cắt bỏ phức tạp liên quan các biến chứng nặng tiềm ần. ở hầu hết các trung tâm, bệnh nhân được xem xét thủ thuật cắt bỏ dựa vào triệu chứng thường xuyên của các cơn rung nhĩ (ít nhất 2 đợt mỗi tháng) và đề kháng ít nhất 1 thuốc chống loạn nhịp (nhóm I hoặc III). Quá trình cắt bỏ chỉ được xem xét trên bệnh nhân có triệu chứng, vì lợi ích của triệt phá rung nhĩ chưa được chứng minh trên bệnh nhân không có triệu chứng. Tỷ lệ thành công được báo cáo khoảng 70-90% (bảng 30.12). Các nghiên cứu so sánh kết cục bệnh nhân điều trị bằng các thuốc chống loạn nhịp so với phẫu thuật triệt phá rung nhĩ đang tiến hành và một số kết quả đáng mong đợi.
Bảng 30.12 Tỷ lệ thành công trong các nghiên cứu triệt phát rung nhĩ khác nhau
| Reference | Vùng thương tổn | Rung nhĩ kịch phát (no.) | Chấm dứt rung nhĩ
Inducibility |
Follow-up (months) | Success off drugs | |
| Haissaguerre etal. [187] | R ± L lines | 45 | 40% RA | 100% RA | 11 | 13% RA |
| 80% LA | 40% LA | |||||
| Oral et al. [181] | PVI | 49 | ? | 27% | 5 | 61% |
| Nademanee et al. [186] | CFAES | 57 | 100% | 0% | 12 | 89% |
| Haissaguerre et al. [163] | PVI ± mitral isthmus | 70 | 75% | 53/23% | 7 | 74/83% |
| Oral et al. [197] | PVA + lines (anatomical) | 100 | 54/90% | 60/10% | 6 | 67/86% |
| Pappone et al. [185] | PVA + lines (anatomical) | 297 | ? | Not used | 12 | 85% |
| Ouyang et al. [171] | PVI | 41 | ? | Not used | 6 | 95% |
CFAES, complex fractionated atrial electrogram signals; PVA, pulmonary vein ablation (lesions encircling the pulmonary veins without aim or demonstration to produce complete isolation); PVI, pulmonary vein isolation (lesions encircling the veins are complete, producing the disappearance of venous potentials or their dissociation).
Gần đây, chúng tôi quan sát có nhóm nhỏ bệnh nhân có hiện tượng ngưng xoang kéo dài chỉ khi chấm dứt rung nhĩ (hội chứng tim nhanh tim chậm), trong đó phẫu thuật cắt bỏ và ngưng dùng các thuốc chống loạn nhịp liên quan hồi phục chức năng xoang, không còn yêu cầu tạo nhịp [199]. Nhóm nhỏ này có thể tập hợp thành nhóm bệnh nhân rung nhĩ kịch phát hưởng lợi từ chiến lược điều trị triệt tiêu rung nhĩ ngay từ đầu.
Trong rung nhĩ dai dẳng hoặc vĩnh viễn, phẫu thuật cắt bỏ đặc biệt khó khăn. Hậu quả là, hầu hết các triệu chứng liên quan rối loạn nhịp đổ lỗi cho do phẫu thuật gây ra. Một lần nữa, rối loạn nhịp kháng các thuốc chống loạn nhịp, có thể gồm amiodarone. Tuy nhiên, thấy các bệnh nhân mắc biến chứng rung nhĩ lược phẫu thậm chí ràng, lợi như phân để duy trì nhịp xoang được và nhĩ thành khích hơn thuật kỹ thuật so với nghiên M o rady môn sánh trên vĩnh hơn khi áp dụng phẫu thuật cắt bỏ.
các sơ đồ phẫu thuật cũng tập trung vào tĩnh mạch phổi. Các tĩnh mạch có thể được bao quanh theo nhiều phương pháp khác nhau: từng cái một, hai lần hai, hoặc bốn lần bốn. Các thương tổn tiếp tuyến có được sử dụng kết hợp với PVI hoặc sử dụng riêng lẻ. Ví dụ, các thương tổn tiếp tuyến liên kết với lỗ tĩnh mạch phổi, sau đó mở rộng đến vòng van 2 lá, đã được sử dụng với tỷ lệ thành công cao. Tuy nhiên, hiện nay tổn thương đầu tiên trong số này đã bị loại bỏ do tỷ lệ rò cao giữa tâm nhỉ trái sau và thực quản [203].
Hình 30.18 Các kết quả tổng hợp phẫu thuật cắt bỏ qua catheter trên 58 bệnh nhân suy tim sung huyết. Chú ý sự cải thiện quan trọng quan sát được trên 92% bệnh nhân có tỷ lệ kiểm soát tần số nghèo nàn và bệnh cơ tim dãn nở không rõ nguyên nhân cho thấy tỷ lệ suy tim cao ít nhất 1 phần là do rung nhĩ trong nhóm bệnh nhân này.
Các nguồn năng lượng khác nhau được ủng hộ thay thế dao phẫu thuật: tần số vô tuyến, phẫu thuật lạnh, siêu âm tập trung và vi sóng. Tuy nhiên tại thời điểm hiện tại, hầu hết các trung tâm sử dụng tần số vô tuyến hoặc/và nguồn năng lượng lạnh. Trong số này, tần số vô tuyến được dùng rộng rãi và có tỷ lệ an toàn/hiệu quả cao. Phẫu thuật lạnh, mặc dù an toàn hơn về nguy cơ hẹp tĩnh mạch phổi, có bất lợi trong thời gian làm kéo dài và thường phục hồi lại các vùng sau khi đã điều trị.
Chiến lược và công nghệ tốt nhất cho phẫu thuật vẫn còn đang đánh giá. Tuy nhiên, hầu hết các sơ đồ phẫu thuật hiện tại gồm bao quah tĩnh mạch phổi, thường kết hợp các thương tổn tuyến tính liên kết với vòng van 2 lá bên (hình 30.19). Tuy nhiên, điều quan trọng cần phải chú ý là hầu hết các cách tiếp cận này được thực hiện khi tim ngừng đập , làm bác sĩ phẫu thuật không thể làm bất kỳ loại ánh xạ nào để đánh giá mức độ hoàn chỉnh của thương tổn, do đó tái mắc vòng vào lại trên phạm vi lớn [203]. Tuy nhiên, nhược điểm này phải được cân bằng với lợi ích rõ ràng là phẫu thuật viên có thể làm thủ thuật qua tầm nhìn trực tiếp. Gần đây hơn, một vài nhà nghiên cứu đã phát triển các thủ thuật xâm lấn tối thiểu khi tim còn đập, do đó có thể ánh xạ quy trình thủ thuật [204].
Quy trình này thường hoàn thành trong vòng 15-30 phút. Tỷ lệ tử vong và tỷ lệ mắc sau phẫu thuật cách đây 10 năm chiếm tỷ lệ lớn, nhưng hiện nay các báo cáo đã thấp hơn 1%. Tỷ lệ thành công lâu dài được báo cáo bằng can thiệp phẫu thuật là 50-95%, với thay đổi đáng kể tỷ lệ mắc tái lập lớn tâm nhĩ trái khi theo dõi. Gần đây, thủ thuật này chủ yếu khuyến cáo làm trên bệnh nhân rung nhĩ cần phải phẫu thuật tim do bất kỳ nguyên nhân gì. Nhìn chung người ta đồng ý rằng các trường hợp không có chỉ định phẫu thuật tim, điều trị rung nhĩ bằng phẫu thuật không phải là lựa chọn đầu tay.
Tổng kết
Thập kỷ vừa qua đã chứng kiến sự phát triển đáng kể trong việc hiểu rung nhĩ, đưa đến kỹ thuật cắt bỏ qua catheter và phẫu thuật đã chứng minh tính khả thi chửa khỏi rung nhĩ. Quá trình cắt bỏ giới hạn đến các tĩnh mạch phổi và ánh xạ tiêu điểm không tập trung tĩnh mạch phổi giúp nâng cao tỷ lệ thành công trong rung nhĩ kịch phát và 20-30% rung nhĩ dai dẳng hoặc vĩnh viễn. Các kết quả này được cải thiện hơn nữa bằng cách chỉnh sửa chất nền. Bằng chứng mới nổi và cải tiến công nghệ sẽ mở rộng sử dụng các kỹ thuật này trên bệnh nhân rung nhĩ trong tương lai.
Các chiến lược điều trị theo biểu hiện rung nhĩ h4
Các mục tiêu chính trong điều trị rung nhĩ là giảm triệu chứng, ngăn ngừa thuyên tắc do huyết khối và ngăn chặn tỷ lệ mắc và tỷ lệ tử vong. Kết quả của nhiều thử nghiệm củng cố nhu cầu tiếp tục dùng kháng đông để kiểm soát tầm số và nhịp tim trên bệnh nhân rung nhĩ và các yếu tố nguy cơ đột quỵ.
Không phụ thuộc vào sử dụng kháng đông (xem phần trên), bước đầu tiên điều trị rung nhĩ là kiểm soát tần số tim đáp ứng thất và tập trung điều trị bệnh tim nền.
Thông điệp của các nghiên cứu so sánh kiểm soát tần số và nhịp tim trên những người cao tuổi, có thể lựa chọn kiểm soát tần số là chiến lược điều trị chính. Mặc khác, lựa chọn này chỉ có giá trị trên bệnh nhân có ít hoặc không có triệu chứng, vì các triệu chứng nặng vẫn kéo dài mặc dù kiểm soát tốt tần số nên cân nhắc kiểm soát tần số. Do đó, quan trọng phải phân biệt rung nhĩ kịch phát và rung nhĩ kéo dài vì rung nhĩ kịch phát và dai dẳng thường gây các triệu chứng nặng ở bệnh nhân trẻ tuổi, trong khi rung nhĩ ở người lớn tuổi có thể ít được chú ý và dễ tuân thủ kiểm soát tần số thận trọng hơn [205-207].
Quyết định chọn kiểm soát hay tần số nên cá thể hóa điều trị và dựa trên lợi ích mong muốn khi phục hồi nhịp xoang, khả năng duy trì nhịp xoang trong thời gian dài và tiên lượng tác dụng phụ. Hơn thế nữa, khi điều trị thuốc không thành công, phải tính ngay đến điều trị không dùng thuốc (hình 30.20).
Rung nhĩ mới phát hiện hoặc Cơn rung nhĩ đầu tiên
Trên bệnh nhân rung nhĩ khởi phát gần đây, không phải lúc nào cũng rõ liệu biểu hiện ban đầu của rung nhĩ có thật sự là cơn đầu tiên của bệnh nhân này không, đặc biệt có ít hoặc không có triệu chứng, ngoại trừ các bệnh nhân có triệu chứng nặng, thường không cần thiết dùng thuốc kháng đông để dự phòng tái phát và kiểm soát tần số và thuốc chống thuyên tắc do huyết khối nên được sử dụng như liệu pháp đầu tay.
Hầu hết bệnh nhân rung nhĩ dai dẳng ít nhất phải cố gắng chuyển nhịp và duy trì nhịp xoang. Điều trị tiếp theo phải dựa vào tỷ lệ tái phát và mức độ bệnh tim nền (bệnh nhân trẻ tuổi, không tăng huyết áp, kích thước nhĩ trái bình thường, thời gian rung nhĩ ngắn) [18, 208].
Hình 30.20 Điều trị rung nhĩ không dùng thuốc
Rung nhĩ kịch phát
Nếu rối loạn nhịp không tự giới hạn, các thuốc chống loạn nhịp có thể cho để khôi phục nhịp xoang. Trong trường hợp này, các hướng dẫn của ESC/ACC/AHA [18] nêu rõ rằng bệnh nhân rung nhĩ < 7 ngày, flecainide, propafenone, ibutilide hoặc dofetilide là lựa chọn đầu tay nếu cân nhắc thay thế thuốc. Amiodarone liều cao và quinidine uống có thể dùng trên bệnh nhân chọn lọc như lựa chọn thứ yếu. Do tỷ lệ thành công của chuyển nhịp bằng thuốc giảm dần khi thời gian rối loạn nhịp tăng lên, lựa chọn thuốc sau đó bị giới hạn, còn lại là dofetilide, ibutilide và có thể là amiodarone (xem bảng 30.8).
Điều trị dự phòng bằng thuốc chống rối loạn nhịp thường không được khuyến cáo sau đợt rối loạn nhịp đầu tiên, có thể tự chấm dứt (hoặc phải dùng thuốc hay chuyển nhịp bằng sốc điện), và trên bệnh nhân có các đợt rung nhĩ không thường xuyên, tự giới hạn, ít triệu chứng. Tuy nhiên, rung nhĩ dai dẳng là bệnh mạn tính vì rối loạn nhịp tim có xu hướng tiến triển thành rối loạn nhịp kéo dài, thậm chí vĩnh viễn. Hơn thế nữa, đại đa số bệnh nhân trải qua các đợt kịch phát thường xuyên, do đó dự phòng bằng thuốc chống rối loạn nhịp thường được khuyến cáo đối với bệnh nhân có triệu chứng nặng.
Trên bất kỳ bệnh nhân nào, một số loại thuốc có thể hiệu quả và lựa chọn ban đầu chủ yếu dựa vào sự an toàn. Thuốc chống rối loạn nhịp được khuyến cáo bởi các hướng dẫn của ESC/AHA/ACC được tổng hợp trong hình 30.12 phụ thuộc vào bệnh tim nền. Đối với từng bệnh nhân có bệnh tim nhẹ hoặc không mắc bệnh tim, thuốc nhóm IC và sotalol thì dung nạp tốt, được khuyến cáo như lựa chọn đầu tay. Lựa chọn thứ 2 và 3, được lựa chọn trong trường hợp kém hiệu quả hoặc mắc tác dụng phụ, là amiodarone, disopyramide, procainamide và quinidine.
Trên bệnh nhân rung nhĩ do phế vị, flecainide, disopyramide và quinidine có thể hiệu quả do tác dụng tiêu phế vị. Mặc khác, thuốc chẹn beta hoặc sotalol được gợi ý dùng khi rung
Bệnh nhân mắc bệnh tim thiếu máu cục bộ thường cần dùng thuốc chẹn beta. Chẹn beta hoặc sotaol là lựa chọn đầu tay nếu không có bệnh tim. Amiodarone và dofetilde, nếu có sẵn, là các thuốc lựa chọn thứ 2. Chọn thuốc chống rối loạn nhịp trên bệnh nhân tăng huyết áp thì thiếu các thử nghiệm thuốc kháng đông trong tương lai so sánh tính an toàn và hiệu quả.
Các thuốc chẹn beta hoặc digitalis có thể cần để kiểm soát tần số thất trong trường hợp tái phát. Điều này đặc biệt đúng trên bệnh nhân rối loạn huyết động có nguy cơ mất bù. Nếu amiodarone hoặc sotaol được dùng như thuốc dự phòng, không cần thiết bổ sung thêm thuốc kiểm soát tần số.
Một cách tiếp cận không dùng thuốc như cắt bỏ rung nhĩ qua catheter có thể phù hợp trong rung nhĩ dai dẳng, nhưng phải đủ cơ sở để chứng minh cần thiết dùng phương pháp này vì là thủ thuật phức tạp do các biến chứng tương đối hiếm gặp nhưng có khả năng nghiêm trọng. Trong hầu hết các trung tâm, bệnh nhân cân nhắc làm phẫu thuật cắt bỏ dựa trên các cơn có triệu chứng thường xuyên (ít nhất 2 cơn mỗi tháng) đề kháng với ít nhất 1 thuốc chống rối loạn nhịp (nhóm I hoặc III). Phẫu thuật cắt bỏ chỉ nên cân nhắc trên bệnh nhân có triệu chứng, do lợi ích của phẫu thuật triệt phá rung nhĩ vẫn chưa được chứng minh trên bệnh nhân không có triệu chứng.
Rung nhĩ dai dẳng
Rung nhĩ dai dẳng không dừng lại 1 cách tự nhiên và rất khó để chữa khỏi bằng thuốc chuyển nhịp. Điều trị đầu tay là chuyển nhịp sốc điện bằng dòng điện 1 chiều. Chỉ khoảng 50% bệnh nhân duy trì nhịp xoang sau 1 năm chuyển nhịp, hầu hết bệnh nhân cần điều trị dự phòng. Hầu hết các thuốc đều hiệu quả như nhau, ngoại trừ amiodarone hiệu quả hơn. Lựa chọn nên dựa trên cùng 1 sơ đồ dùng cho bệnh nhân rung nhĩ dai dẳng (xem hình 30.12, bảng 30.8 và 30.9).
Kiểm soát tần số dường như phù hợp hơn như chiến lược điều trị chính trên bệnh nhân rung nhĩ có triệu chứng nhẹ, rung nhĩ dai dẳng và thất bại khi chuyển nhịp lặp lại cộng với thuốc chống loạn nhịp dự phòng và những bệnh nhân có tỷ lệ lợi ích – nguy cơ tác dụng phụ khi dùng thuốc chống loạn nhịp. Kết quả của những nghiên cứu so sánh kiểm soát tần số và kiểm soát nhịp [43-46] liên quan bệnh nhân lớn tuổi và không thể ngoại suy cho bệnh nhân trẻ tuổi, những người khả năng nhiều có triệu chứng và suy giảm chất lượng cuộc sống hơn khi đã kiểm soát tần số tốt. Đối với rung nhĩ dai dẳng hoặc vĩnh viễn, cắt bỏ qua catheter thì khó khăn và do đó các triệu chứng chính phải liên quan rối loạn nhịp tim để chứng minh làm phẫu thuật là đúng. Một lần nữa, rung nhĩ phải kháng với 1 thuốc chống loạn nhịp kể cả amiodarone.
Rung nhĩ vĩnh viễn
Kiểm soát tần số là chiến lược chính trên bệnh nhân rung nhĩ vĩnh viễn, tức là không thể duy trì nhịp xoang sau chuyển nhịp hoặc khi đã từ bỏ các nỗ lực khôi phục nhịp xoang (không cải thiện triệu chứng, tác dụng phụ không mong muốn, thúc đầy rối loạn nhịp, rối loạn chức năng nút xoang). Khi các triệu chứng của bệnh nhân liên quan tần số tim nhanh và không đều trong thời gian rung nhĩ không thể kiểm soát bằng các thuốc giảm tần số tim hoặc tiến triển giảm chức năng tâm thất thông qua nhịp nhanh, cắt bỏ nút nhĩ thất có thể hữu ích (xem bảng 30.11). Cần thêm dữ liệu để chứng minh lợi ích của chiến lược điều trị triệt phá rung nhĩ trên bệnh nhân suy tim [200].
Rung nhĩ trong suy tim sung huyết
Bệnh nhân suy tim sung huyết đặc biệt dễ bị tác dụng phụ của thuốc chống loạn nhịp. Sốc điện chuyển nhịp có thể cân nhắc trên bệnh nhân trẻ tuổi có thời gian rối loạn nhịp ngắn và suy tim còn bù. Chuyển nhịp lặp đi lặp lại trong thời gian 6 tháng là cách thích hợp để ngăn ngừa tiến triển suy tim. Trong trường hợp này, amiodarone hoặc dofetilide là các thuốc được lựa chọn để dự phòng tái phát vì chúng được chứng minh an toàn và hiệu quả trong bài này [96, 97]. Cả 2 loại thuốc đều không liên quan suy giảm chức năng thất trái cũng như không gây tác dụng phụ rối loạn nhịp tim miễn sao chúng được dùng lúc đầu và theo dõi cần thận [18].
Tất cả bệnh nhân suy chức năng thất trái cũng nên điều trị bằng chẹn beta và ức chế men chuyển bởi vì không những kéo dài thời gian sống mà còn giúp kiểm soát tần số (chẹn beta) hoặc “chống loạn nhịp” (chẹn beta và ức chế men chuyển). Hơn thế nữa, các thuốc không chống loạn nhịp có thể đóng vai quan trọng trong kiểm soát tần số. Các nghiên cứu thực nghiệm và lâm sàng cho thấy lợi ích của ức chế men chuyển và chẹn thụ thể angiotensin II [205-207, 209]. Mức độ ảnh hưởng của chúng có thể khiêm tốn nhưng nếu áp dụng trên một quần thể lớn, thì lợi ích mang lại rất đáng kể. Sự gia tăng bằng chứng chứng minh các thuốc này có thể được kê đơn hiệu quả trên bệnh nhân rung nhĩ không có suy tim Ơ205-207, 209].
Bệnh nhân rối loạn nhịp không được kiểm soát hoặc có nhiều tác dụng phụ do các thuốc chống loạn nhịp, mà không có triệu chứng, bệnh nhân lớn tuổi và bệnh nhân gia tăng kích thước tâm nhĩ trái là các ứng viên kém trong cách tiếp cận này để duy trì nhịp xoang và nên cân nhắc kiếm soát tần số. Khoảng 10-15% bệnh nhân đề kháng với thuốc có thể cải thiện triệu chứng bằng cách cắt bỏ nút nhĩ that qua catheter, bất cấp cần phải đặc máy tạo nhịp [150, 153]. Kết quả ban đầu của cắt bỏ qua catheter trong bệnh cảnh suy tim, dù được khuyến khích, cần phải được chứng minh [48].
Rung nhĩ sau phẫu thuật tim
Rung nhĩ sau phẫu thuật chủ yếu xảy ra 4 ngày đầu sau phẫu thuật liên quan tăng tỷ lệ mắc, tỷ lệ tử vong và nằm viện lâu dài. Kiểm soát tần số có thể ưu tiên khi không có rối loạn huyết động hoặc triệu chứng dung nạp nghèo nàn vì rung nhĩ sau phẫu thuật hầu như tự giới hạn, với khả năng cao tự phát chuyển về nhịp xoang sau vài tuần. Trong bệnh cảnh này, chẹn beta hoặc sotalol có thể cân nhắc như lựa chọn đầu tay vì tác dụng có lợi đối với tình trạng cường adrenergic sau phẫu thuật. Mặc khác, có bằng chứng thuyết phục cho thấy điều trị dự phòng bằng amiodarone có thể giảm tỷ lệ mắc và thời gian rung nhĩ sau phẫu thuật [205].
Tổng kết
Rung nhĩ vẫn còn là thách thức lớn do ngày càng phổ biến và tính chất phức tạp. Không chắc nếu chỉ dùng 1 phương pháp điều trị đơn thuần sẽ mang lại cuộc cách mạng quản lý rung nhĩ. Các chiến lược điều trị toàn diện gồm thuốc chống rối loạn nhịp mới và các thuốc không chống rối loạn nhịp, điều trị không dùng thuốc như cắt đốt qua catheter và cải thiện kháng đông sẽ rất cần thiết để mang đến sự an toàn và hiệu quả cho nhiều bệnh nhân rung nhĩ.
Suy nghĩ trong tôi
Mặc dù có nhiều phương pháp điều trị hiện nay khôi phục và duy trì nhịp xoang nhĩ trên bệnh nhân rung nhĩ, thành công lâu dài vẫn còn đáng thất vọng. Một vài thử nghiệm lâm sàng kết luận rằng kiểm soát nhịp tim là một lựa chọc thay thế có thể chấp nhận được đối với bệnh nhân rung nhĩ tái phát. Tuy nhiên, rung nhĩ đại diện cho thách thức đáng kể với tỷ lệ ngày càng tăng, tính chất phức tạp và không đồng nhất.
ức chế men chuyển và chẹn thụ thể angiotensin dường như hữu ích trong dự phòng rung nhĩ bằng cách chống lại các kênh được kích hoạt kéo dài và/hoặc chẹn trực tiếp thụ thể angiotensin II. Những tiến bộ trong sinh thiết phân tử cũng đầy hứa hẹn. Mặc khác, những tiến bộ quan trong nhất trong việc giảm tỷ lệ tử vong và tỷ lệ mắc rung nhĩ đến từ nhiều thử nghiệm cho thấy sự cần thiết dùng kháng đông lâu dài và thậm chí mãi mãi trên những bệnh nhân đang uống thuốc chống rối loạn nhịp nếu có các yếu tố nguy cơ thuyên tắc do huyết khối. Sự phát triển của các thuốc kháng đông mới như thuốc uống ức chế hình thành cục máu đông có thể dễ dàng trong việc kê đơn.
Cô lập tĩnh mạch phổi và thay đổi chất nền bằng cắt bỏ qua catheter (hoặc phẫu thuật) đã nổi lên như một thủ thuật an toàn và hiệu quả điều trị rung nhĩ. Những tiến bộ về công nghệ sẽ cải thiện tính hiệu quả, giảm các biến cố bất lợi và rút ngắn thời gian làm thủ thuật cắt đốt qua catheter. Trong thời gian ngắn, thủ thuật này sẽ được đánh giá đầy đủ trong các thử nghiệm ngẫu nhiên và có khả năng sẽ được chỉ định rộng rãi.
Cá thể hóa điều trị là điều tối quan trọng khi điều trị rung nhĩ. Với hàng triệu bệnh nhân có nguy cơ mắc rung nhĩ trong vòng 10 năm nữa, tiến bộ đáng kể trong điều trị này sẽ vô cùng đúng lúc.
References
- Flegel KM, Shipley MJ, Rose G. Risk of stroke in nonrheumatic atrial fibrillation. Lancet 1987; i: 526-529.
- Wolf PA, Dawber TR, Thomas HE Jr et Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: the Framingham study. Neurology 1978; 28: 973-977.
- Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation: analysis of pooled data from five randomised controlled trials. Arch Intern Med 1994; 154: 1449-1457.
- Kopecky SL, Gersh BJ, McGoon MD et al. The natural history of lone atrial fibrillation. A population-based study over three decades. N Engl J Med 1987; 317: 669-674.
- Blackshear JL, Odell JA. Appendage obliteration to reduce stroke in cardiac surgical patients with atrial fibrillation. Ann ThoracSurg 1996; 61: 755-759.
- Halperin JL, Hart RG. Atrial fibrillation and stroke: new ideas, persisting dilemmas. Stroke 1988; 19: 937-941.
- Ho SY, Sanchez-Quintana D. Structure of the left atrium. Eur Heart J 2002; 2 (suppl. K): K4-K8.
- Ernst G, Stollberger C, Abzieher F et al. Morphology of the left atrial appendage. Anat Rec 1995; 242: 553-561.
- Al-Saady NM, Obel OA, Camm AJ. Left atrial appendage: structure, function, and role in thromboembolism. Heart 1999; 82: 547-555.
- Schotten U, Duytschaever M, Ausma J et al. Electrical and contractile remodelling during the first days of atrial fibrillation go hand in hand. Circulation 2003; 107: 1433-1439.
- Thijesen VL, Ausma J, Liu GS et al. Structural changes of atrial myocardium during chronic atrial fibrillation. Cardiovasc Pathol 2000; 9: 17-28.
- Takada T, Yasaka M, Nagatsuka K et al. Blood flow in the left atrial appendage and embolic stroke in nonvalvular atrial fibrillation. Eur Neurol 2001; 46: 148-152.
- Albers GW, Sherman DG, Gress DR et al. Stroke prevention in non-valvular atrial fibrillation: a review of prospective randomised trials. Ann Neurol 1991; 30: 511518.
- Tinkler K, Cullinane M, Kaposzta Z et al. Asymptomatic embolisation in non-valvular atrial fibrillation and its relation to anticoagulation therapy. Eur J Ultrasound 2002; 15: 21-27.
- Peterson P, Boysen G, Godtfredsen J et al. Placebo- controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet 1989; i: 175-179.
- Hart RG, Benavente O, McBride BS et al. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann Intern Med 1999; 131: 492-501.
- Hart RG. Atrial fibrillation and stroke prevention. N Engl J Med 2003; 349: 1015-1016.
- Fuster V, Rydén LE, Asinger RW et al. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation). Eur Heart J 2001; 22: 1852-1923.
- Attermann J. Inaccuracy of international normalized ratio (INR) measurements and suggestions for improved WHO guidelines for calibration of reference preparations: a statistical study. J Thromb Haemost 2003; 1: 537-544. Hylek EM, Skates SJ, Sheehan MA et al. An analysis of the lowest effective intensity of prophylactic anticoagulation for patients with nonrheumatic atrial fibrillation. N Engl J Med 1996; 335: 540-546.
- Hylek EM, Singer DE. Risk factors for intracranial hemorrhage in outpatients taking warfarin. Ann Intern Med 1994; 120: 897-902.
- Odén A, Fahlén M. Oral anticoagulation and risk of death: medical record linkage study. Br Med J 2002; 325: 1073-1075.
- Go AS, Hylek EM, Chang Y et al. Anticoagulation therapy for stroke prevention in atrial fibrillation. How well do randomized trials translate into clinical practice? JAMA 2003; 290: 2685-2692.
- Executive Steering Committee on behalf of the SPORTIF III Investigators. Stroke prevention with the oral direct thrombin inhibitor ximelagatran compared with warfarin in patients with non-valvular atrial fibrillation (SPORTIF III): randomised controlled trial. Lancet 2003; 362: 1691-1698.
- Bungard TJ, Ghali WA, Teo KK et al. Why do patients with atrial fibrillation not receive warfarin? Arch Intern Med 2000; 160: 41-46.
- Olsson SB for the Executive Steering Committee on Behalf of the SPORTIF Investigators. Stroke prevention with the oral direct thrombin inhibitor ximelagatran in patients with nonvalvular atrial fibrillation: final results of the pooled analysis of the SPORTIF III and V trials (abstract). Eur Heart J 2004; 25 (Abstract Suppl, Aug/Sept): 643, Abstract No. 3703.
- Halperin JL, and the executive steering committee, on behalf of the SPORTIF III and V study investigators. Ximelagatran compared with warfarin for prevention of thromboembolism in patients with nonvalvular atrial fibrillation: rationale, objectives, and design of a pair of clinical studies and baseline patient characteristics (SPORTIF III and V). Am Heart J 2003; 146: 431-438. Petersen P, Godtfredsen J. Embolic complications in paroxysmal atrial fibrillation. Stroke 1986; 17: 622-626. Inoue H, Atarashi H for the Research Group for Antiarrhythmic Drug Therapy. Risk factors for thromboembolism in patients with paroxysmal atrial fibrillation. Am J Cardiol 2000; 86: 852-855.
- Biblo LA, Yuan Z, Quan KJ et al. Risk of stroke in patients with atrial flutter. Am J Cardiol 2001; 87: 346-349, A9. Bjerkelund CJ, Orning OM. The efficacy of anticoagulant therapy in preventing embolism related to D.C. electrical conversion of atrial fibrillation. Am J Cardiol 1969; 23: 208-216.
- Berger M, Schweitzer P. Timing of thromboembolic events after electrical cardioversion of atrial fibrillation or flutter: a retrospective analysis. Am J Cardiol 1998; 82: 1545-1546. Khan IA. Atrial stunning: basics and clinical considerations. Int J Cardiol 2003; 92: 113-128.
- Gallagher MM, Hennessy BJ, Edvardsson N et al. Embolic complications of direct current cardioversion of atrial arrhythmias: association with low intensity of anticoagulation at the time of cardioversion. J Am Coll Cardiol 2002; 40: 926-933.
- Asher CR, Klein AL. Transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation: ACUTE trial update. Card Electrophysiol Rev 2003; 7: 387-391.
- Roijer A, Eskilsson J, Olsson B. Transoesophageal echocardiography-guided cardioversion of atrial fibrillation or flutter. Selection of a low-risk group for immediate cardioversion. Eur Heart J 2000; 21: 837-847.
- Stellbrink C, Nixdorff U, Hofmann T et al. on behalf of the ACE (Anticoagulation in Cardioversion using Enoxaparin) Study Group. Safety and efficacy of enoxaparin comparea with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation 2004; 109: 997-1003.
- Johnson WD, Ganjoo AK, Stone CD et al. The left atrial appendage: our most lethal human attachment! Surgical implications. Eur J Cardiothorac Surg 2000; 17: 718-722.
- Stõllberger C, Finsterer J, Ernst G et al. Is left atrial appendage occlusion useful for prevention of stroke or embolism in atrial fibrillation? Z Kardiol 2002; 91: 376-379.
- Crystal E, Lamy A, Connolly SJ et al. Left atrial appendage occlusions study (LAAOS): a randomized clinical trial of left atrial appendage occlusion during routine coronary artery bypass graft surgery for long-term stroke prevention. Am Heart J 2003; 145: 174-178.
- Sievert H, Lesh MD, Trepels T et al. Percutaneous left atrial appendage transcatheter occlusion to prevent stroke in high-risk patients with atrial fibrillation. Early clinical experience. Circulation 2002; 105: 1887-1889.
- Meier B, Palacios I, Windecker S et al. Transcatheter left atrial appendage occlusion with Amplatzer devices to obviate anticoagulation in patients with atrial fibrillation. Catheter CardiovascInterv 2003; 60: 417-422.
- Hohnloser SH, Kuck KH, Lilienthal J for the PIAF Investigators. Rhythm or rate control in atrial fibrillation: Pharmacological Intervention in Atrial Fibrillation (PIAF). A randomised trial. Lancet 2000; 356: 1789-1794.
- Carlsson J, Miketic S, Windeler J et al. Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation. The Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol 2003; 41: 1690-1696.
- Van Gelder IC, Hagens VE, Bosker HA et al.; Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347: 1834-1840.
Để lại một phản hồi