Nội dung chính
Bài viết Cơ học hô hấp để hiểu ARDS và hướng dẫn thở máy – tải về tại đây.
Tommaso Mauri, Marta Lazzeri, Gỉaccmo Bellanr, Alberto Zanella và Giacomo Grasseiii.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Mục tiêu: Vì y học chính xác đang trở thành một tiêu chuẩn chăm sóc trong việc lựa chọn các phương pháp điều trị phù hợp thay vì thông thường, các phép đo sinh lý có thể là bước đầu tiên trong việc áp dụng liệu pháp cá nhân hóa trong phòng chăm sóc đặc biệt (intensive care unit, ICU). Đánh giá có hệ thống về cơ học hô hấp ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome, ARDS) có thể là một bước đi theo hướng này, vì hai lý do chính.
Cách tiếp cận và kết quả chính: Một mặt, cơ học hô hấp là một phương pháp sinh lý mạnh mẽ để hiểu được mức độ nghiêm trọng của hội chứng này ở mỗi bệnh nhân. Ví dụ, độ giãn nở của hệ hô hấp giảm có liên quan đến thể tích phổi thở ra thấp và tổn thương phổi nghiêm trọng hơn.
Mặt khác, cơ học hô hấp có thể hướng dẫn cài đặt thông khí cơ học bảo vệ. Cải thiện độ giãn nở của phổi khu vực phụ thuộc vào trọng lực có thể hỗ trợ việc lựa chọn áp lực dương cuối thì thở ra và tối đa hóa việc huy động phế nang. Hơn nữa, mối liên quan giữa áp lực đẩy đường thở và tỷ lệ tử vong ở bệnh nhân ARDS có khả năng nhấn mạnh tầm quan trọng của việc xác định thể tích khí lưu thông theo độ giãn nở của hệ hô hấp hơn là trọng lượng cơ thể dự đoán.
Ý nghĩa: Bài viết đánh giá hiện tại nhằm mục đích mô tả những thay đổi chính của cơ học hô hấp trong ARDS như một công cụ hữu hiệu tại giường bệnh để hiểu mức độ nghiêm trọng và hướng dẫn cài đặt thở máy, do đó đại diện cho nguồn tài nguyên lâm sàng sẵn có cho các bác sĩ ICU.
Giới thiệu
Kể từ mô tả đầu tiên trong Ashbaugh và cộng sự (1967), cơ học hô hấp đã được nghiên cứu rộng rãi như một công cụ theo dõi hữu ích để đánh giá mức độ nghiêm trọng của hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome, ARDS). Thật vậy, phổi cứng cần áp lực thông khí cao để trao đổi khí bình thường được công nhận rộng rãi là dấu hiệu đặc trưng của ARDS (Gattinoni và Pesenti 2005). Gần đây, những tiến bộ công nghệ và hiểu biết sâu sắc về tổn thương phổi do máy thở (ventilator- induced lung injury, VILI) đã nâng cao hơn nữa kiến thức về tầm quan trọng của cơ học hô hấp toàn cầu và khu vực trong ARDS (Bellani và cộng sự 2011). Các biện pháp đơn giản như áp lực đẩy đường thở (airway driving pressure) đã được mô tả là yếu tố dự báo độc lập mạnh mẽ về tỷ lệ tử vong ARDS (Amato Mauri 2017 Respiratory mechanics to understand ARDS và cộng sự 2015), và đánh giá phức tạp về tương tác phế nang như tính không đồng nhất của thông khí động được đề xuất như một cơ chế chính của VILI (Mauri và cộng sự 2013).
Trong bài viết đánh giá hiện tại, chúng tôi sẽ trình bày các biện pháp cổ điển và gần đây hơn về cơ học hô hấp và chỉ ra cách chúng có thể hỗ trợ công việc lâm sàng, chẩn đoán và điều trị ARDS. Cơ học hô hấp có thể thúc đẩy sự hiểu biết về mức độ nghiêm trọng của từng cá nhân (tức là cái gọi là ‘kiểu hình’ ARDS) và trở thành mục tiêu của cài đặt thông khí cơ học được cá nhân hóa.
Độ giãn nở của hệ hô hấp
Phổi của bệnh nhân mắc ARDS không đồng nhất về mặt cơ học và khác nhau về kiểu thâm nhiễm và tính chất cơ học. Trong giai đoạn sớm nhất, ARDS được đặc trưng bởi tình trạng phù nề có tính thấm cao và khoảng khí phế nang (alveolar airspace) bị chiếm giữ bởi dịch protein và thâm nhiễm tế bào. Sự phá hủy tế bào phế nang loại II sản xuất chất hoạt động bề mặt dẫn đến giảm sản xuất với sức căng bề mặt và độ đàn hồi của mô tăng lên, xẹp đường dẫn khí nhỏ, ngập phế nang và xẹp phổi (Ashbaugh và cộng sự 1967).
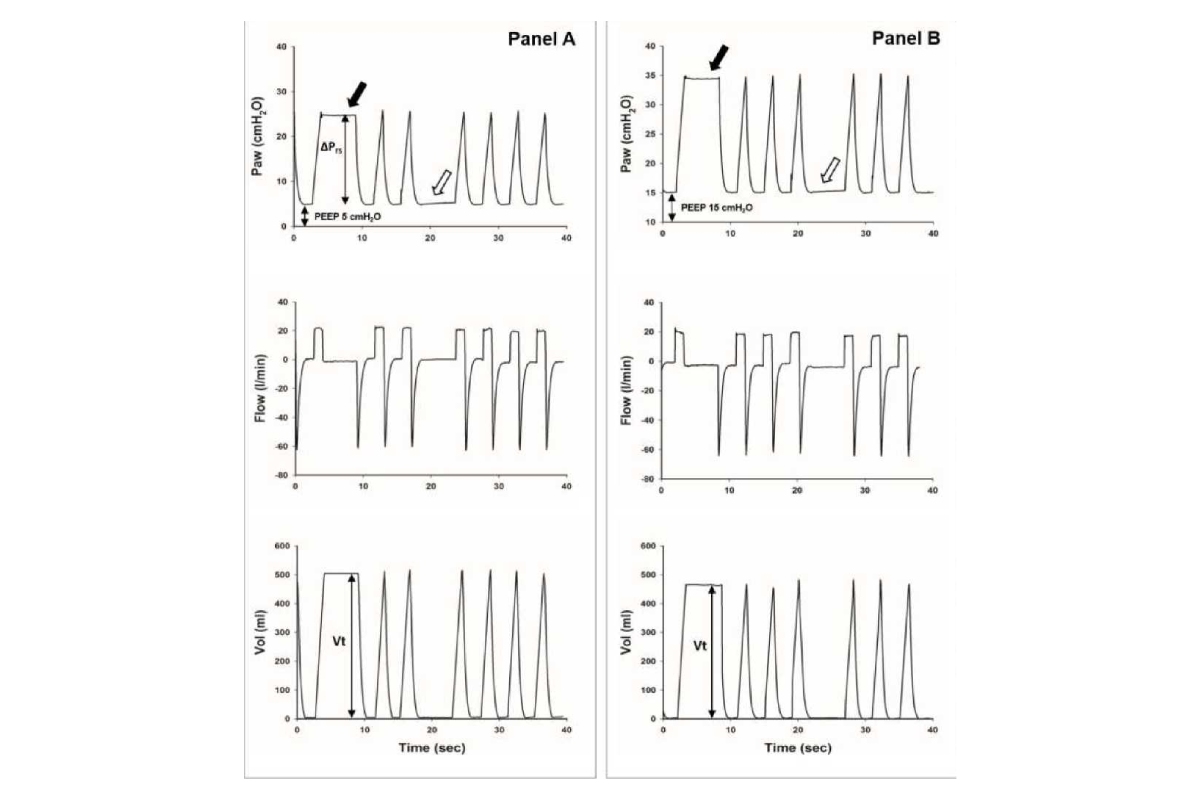
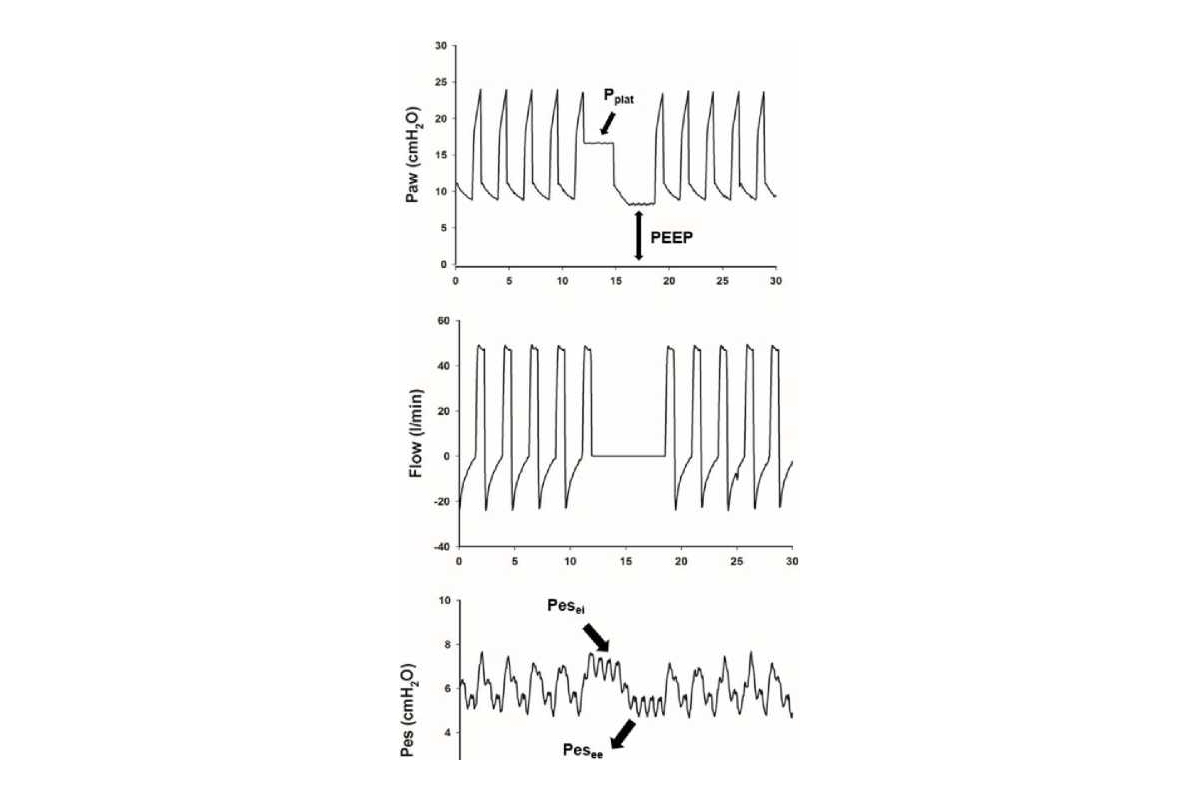
Do đó, việc lấp đầy khoảng khí bởi các tế bào viêm và dịch và sự mất mát hiện tại về chức năng chất hoạt động bề mặt dẫn đến độ giãn nở tĩnh của hệ thống hô hấp bị giảm nghiêm trọng (Crs), được định nghĩa là thể tích khí lưu thông (Vt) chia cho chênh lệch giữa áp lực cao nguyên cuối thì hít vào (Pplat) và tổng áp lực dương cuối thì thở ra (PEEPtot), thu được trong thủ thuật tắc nghẽn (hình 1):
Crs = Vt/ (Pplat – PEEPtot) (Phương trình 1)
Hầu hết các máy thở có bán trên thị trường liên tục hiển thị Crs động trong quá trình thông khí kiểm soát áp lực, được tính bằng thể tích khí lưu thông chia cho áp lực hít vào đỉnh trừ đi PEEP đã đặt. Một trong những ưu điểm của việc theo dõi Crs động là nó liên tục và không làm thay đổi kiểu thở của bệnh nhân. Tuy nhiên, Crs tĩnh và động có thể khác nhau đáng kể khi có thời gian hít vào ngắn, sức cản đường thở tăng, PEEP nội tại và hít vào chủ động (Stahl và cộng sự 2006, Stenqvist và cộng sự 2008).
Trong quá trình thở máy hỗ trợ, Crs được đo theo cách tương tự, mặc dù với một số bệnh nhân có thể khó thư giãn họ và thu được giá trị Pplat và tổng PEEP chính xác.
Độ giãn nở giảm trong ARDS do mất khoảng khí do viêm; phế nang bị xẹp xuống và không thể nở ra trong thì hít vào. Mô hình hạn chế phổi điển hình này trong ARDS ban đầu được gọi là ‘phổi trẻ em’ (baby lung), được định nghĩa là một phần nhu mô phổi có vẻ khỏe mạnh vẫn duy trì bơm phồng (Gattinoni và cộng sự 2016). Gattinoni và nhóm của ông đã mô tả kích thước của phổi trẻ em có mối tương quan tuyến tính với độ giãn nở của hệ hô hấp và do đó với độ cứng của phổi ARDS. Nói cách khác, họ đưa ra giả thuyết rằng độ giãn nở có thể phản ánh kích thước của phổi trẻ em này và họ cho rằng phổi trong ARDS nhỏ chứ không cứng và các đặc tính đàn hồi của phổi khỏe mạnh còn sót lại gần như bình thường, được biểu thị bằng độ giãn nở đặc hiệu (độ giãn nở/mô thông khí bình thường), tương tự giữa các đối tượng khỏe mạnh và ARDS.
Họ cũng mô tả khái niệm phổi trẻ em không phải là khái niệm giải phẫu: khi xem xét bệnh nhân nằm ngửa trên giường, các đơn vị phổi nằm ở vùng phụ thuộc (trọng lực) bị nén bởi trọng lượng phổi ở trên và làm đông đặc bởi các tế bào viêm và dịch, trong khi phần khoảng khí còn lại không hoạt động. Các đơn vị phổi phụ thuộc gần như được bơm căng bình thường và chúng tượng trưng cho phổi trẻ em. Việc sử dụng tư thế nằm sấp, trong đó phổi trẻ em được coi là một vùng giải phẫu được cho là sẽ trở nên không phụ thuộc, được cho là sẽ cải thiện oxygen hóa bằng cách tăng cường tưới máu cho nó. Tuy nhiên, khi phân tích chụp CT, người ta đã mô tả cách các phế nang bị xẹp được phân bổ lại đến các vùng phụ thuộc của phổi (Gattinoni và Pesenti 2005) và các cơ chế cải thiện oxygen hóa trong quá trình nằm sấp có thể phức tạp hơn.
Nỗ lực đầu tiên nhằm tương quan giữa mức độ nghiêm trọng của ARDS (kích thước phổi, phù nề, xơ hóa, v.v.) và các đặc tính cơ học của nó được đánh giá thông qua phương pháp đường cong áp lực-thể tích (đường cong P/V) ở bệnh nhân suy hô hấp cấp tính (ARF) đã được báo cáo bởi Matamis và cộng sự (1984). Họ sử dụng phương pháp chụp X-quang ngực để theo dõi những thay đổi về mặt giải phẫu của phổi có liên quan đến những rối loạn lâm sàng.
Vài năm sau, Gattinoni và cộng sự (Gattinoni và cộng sự 1987) đã nghiên cứu mối quan hệ giữa cấu trúc giải phẫu thu được từ chụp CT (cung cấp thông tin vùng chính xác hơn về mật độ phổi so với chụp X quang thông thường) và cơ học phổi, thu được từ đường cong P/V ở bệnh nhân ARDS. Họ liên hệ các đặc tính cơ học của phổi với phân tích chụp CT chẳng hạn như thể tích khí phổi và trọng lượng mô (mô phổi được thông khí quá mức, hoặc bình thường, kém hoặc không được thông khí) và họ nhận thấy rằng độ giãn nở dường như phản ánh lượng mô phổi thông khí bình thường. Điều thú vị là độ giãn nở của hệ hô hấp không liên quan đến lượng mô được thông khí kém hoặc không được thông khí, thường được coi là yếu tố cho thấy mức độ nặng của ARDS.
Tuy nhiên, nghiên cứu chụp CT đã chỉ ra rằng phổi của bệnh nhân ARDS không bị ảnh hưởng đồng nhất. Chủ đề này sẽ được đề cập rộng rãi hơn sau này trong bài đánh giá này. Các tác giả đã xây dựng mô hình ba vùng của phổi ARDS, với vùng H (khỏe mạnh, health), với các đặc điểm hình thái bình thường, vùng R (có thể huy động, recruitable) và vùng D (bị bệnh, diseased), bị đông đặc và không đáp ứng với những thay đổi áp lực. Độ giãn nở dường như là một chỉ số hữu ích để chỉ ra mức độ của cả vùng H và R: vùng H và R càng nhỏ thì tổn thương phổi càng nghiêm trọng.
Một chiến lược được đề xuất để bơm phồng lại vùng phổi bị xẹp và cải thiện độ giãn nở là tăng áp lực đường thở trong thời gian ngắn lên mức cao hơn so với thông khí thông thường: các thao tác huy động (recruitment manoeuvres, RM) và thở sâu (sigh) đã được sử dụng theo cách này để thông khí cho bệnh nhân ARDS. RM thường liên quan đến tác dụng sinh lý dương tính ngắn hạn như tăng độ giãn nở của phổi và giảm shunt trong phổi (Hodgson và cộng sự 2016).
Tác động dương tính của RM đối với độ giãn nở đã được Amato và cộng sự (Amato và cộng sự 1995) thể hiện trong một nghiên cứu trong đó bệnh nhân ARDS được chọn ngẫu nhiên thành hai nhóm, nhóm đầu tiên được thở máy theo cách thông thường (Vt = 12 ml/kg, PEEP tối thiểu được hướng dẫn bởi FiO2 và các thông số huyết động cũng như mức PaCƠ2 bình thường) và nhóm thông khí thứ hai bằng một phương pháp khác gây ra huy động (PEEP trên điểm uốn dưới của đường cong áp lực-thể tích, Vt < 6 ml/kg, áp lực đỉnh < 40 cm H2O và tăng CO2 cho phép). Kết quả cho thấy rằng việc sử dụng thể tích khí lưu thông cao có liên quan đến tổn thương phổi và giảm độ giãn nở do sự căng quá mức của phế nang và sự mở lại theo chu kỳ của các phế nang bị xẹp, trong khi các bệnh nhân theo phương pháp huy động cho thấy sự cải thiện đáng kể về độ giãn nở, đặc biệt là trong giai đoạn tuần đầu tiên.
Tuy nhiên, Ranieri và cộng sự (1991) đã chỉ ra rằng nhiều bệnh nhân ARDS có thể biểu hiện độ lõm hướng lên trên của đường cong áp lực-thể tích mà không có điểm uốn dưới (lower inflection point). Tình trạng này có thể phản ánh việc huy động phế nang tiến triển với mức PEEP ngày càng tăng, cho thấy sự hiện diện của bệnh phổi không đồng nhất với ‘áp lực mở’ (opening pressures) khác nhau trên phổi. Họ đã phát triển chỉ số căng thẳng (stress index), phát hiện những thay đổi về độ giãn nở theo thời gian (tức là khi áp lực đường thở tăng lên), đây có thể là mục tiêu tốt hơn để tối ưu hóa PEEP và huy động thay vì bản thân độ giãn nở. Cần lưu ý rằng chỉ số căng thẳng chỉ có thể được đánh giá trong quá trình thông khí kiểm soát thể tích ở bệnh nhân hoàn toàn thụ động.
Xem xét lý thuyết về phổi trẻ em và nguy cơ đóng mở phế nang theo chu kỳ trong quá trình thở máy, các khuyến nghị điều trị hiện tại bao gồm hạn Mauri 2017 Respiratory mechanics to understand ARDS chế thể tích khí lưu thông, giữ áp lực cao nguyên dưới 28-30 cm H2O và duy trì PEEP đủ cao để cải thiện oxygen hóa. Cái gọi là ‘chiến lược thông khí bảo vệ’ này được cho là làm giảm căng thẳng cơ học của phổi do việc mở và đóng phế nang lặp đi lặp lại để duy trì thông khí phế nang và giảm xẹp phổi và VILI. Để đạt được mục đích này, PEEP được chọn dựa trên độ giãn nở tốt nhất của hệ hô hấp (tức là độ giãn nở liên quan đến số lượng đơn vị thông khí tối đa) trong thử nghiệm PEEP giảm dần đã được mô tả là hiệu quả và dường như là một cách sinh lý để cá nhân hóa PEEP.
Xem xét rằng bệnh nhân ARDS nặng không đáp ứng với điều trị thông thường với độ giãn nở thấp và/hoặc áp lực cao nguyên cực cao (tỷ lệ tử vong > 50%), họ có thể là ứng cử viên cho phương pháp oxygen hóa qua màng ngoài cơ thể (extracorporeal membrane oxygenation, ECMO). Gattinoni và cộng sự đã áp dụng một quy trình trong đó bệnh nhân đáp ứng tiêu chí ARDS cho ECMO khi thông khí áp lực dương liên tục (continuous positive pressure ventilation, CPPV) được chuyển sang thông khí tỷ lệ đảo ngược kiểm soát áp lực (pressure-controlled inverted ratio ventilation, PC-IRV). Nếu trong vòng 4 giờ mà tình trạng oxygen hóa không được cải thiện, bệnh nhân sẽ được bắt đầu sử dụng ECMO. Thay vào đó, nếu quá trình trao đổi khí của bệnh nhân PC-IRV được cải thiện, họ sẽ được chuyển sang thở tự nhiên với áp lực đường thở dương liên tục (continuous positive airway pressure, CPAP). Các tác giả tuyên bố rằng giá trị tiên đoán duy nhất cho sự thành công của thông khí hỗ trợ là độ giãn nở của hệ hô hấp. Bệnh nhân có độ giãn nở thấp hơn 25 ml/cm H2O không dung nạp được việc chuyển sang PC-IRV và CPAP, do đó kết thúc bằng ECMO. Các tác giả kết luận rằng độ giãn nở này là một trong những thông số hữu ích nhất trong việc kiểm soát tình trạng không đáp ứng của bệnh nhân ARDS nặng với điều trị thông thường (Gattinoni và cộng sự 1984).
Francineau và các đồng nghiệp đã đề xuất cá nhân hóa việc chuẩn độ PEEP ở những bệnh nhân ARDS nặng trải qua ECMO bằng cách theo dõi họ trong quá trình thử nghiệm PEEP giảm dần thông qua chụp cắt lớp trở kháng điện (electrical impedance tomography, EIT). EIT có thể cung cấp một chỉ số động về tình trạng phổi quá căng và xẹp dựa trên độ giãn nở của khu vực (xem phần 9 bên dưới). Các tác giả, bằng cách giảm thiểu chỉ số này, đã cho thấy sự thay đổi lớn về mức PEEP tối ưu (trong khoảng 5-20 cm H2O), củng cố nhu cầu chuẩn độ PEEP dựa trên sinh lý cá nhân hóa ở những bệnh nhân mắc ARDS nặng này (Franchineau và cộng sự 2017).
Sức cản đường thở
Dữ liệu từ một số mô hình ARDS trên động vật cho thấy sức cản của luồng khí tăng lên trong trường hợp tổn thương phổi lan tỏa (Esbensahde và cộng sự 1982, Brigham và Meyrick 1986, Christley và cộng sự 2013). Tổng sức cản hô hấp ở bệnh nhân ARDS bao gồm sức cản đường thở và sức cản hô hấp ‘bổ sung’ do sự tiêu tán năng động do đặc tính nhớt đàn hồi của hệ hô hấp (phổi và thành ngực) bị thay đổi và không đồng nhất về hằng số thời gian (time-constant) trong nhu mô phổi (Bernasconi và cộng sự 1988, Eissa và cộng sự 1991, Antonaglia và cộng sự 2005). Do đó, sự gia tăng sức cản đường thở trong ARDS có thể được cho là do ngập đường thở, giảm thể tích phổi, phản xạ phế vị và tăng động đường thở.
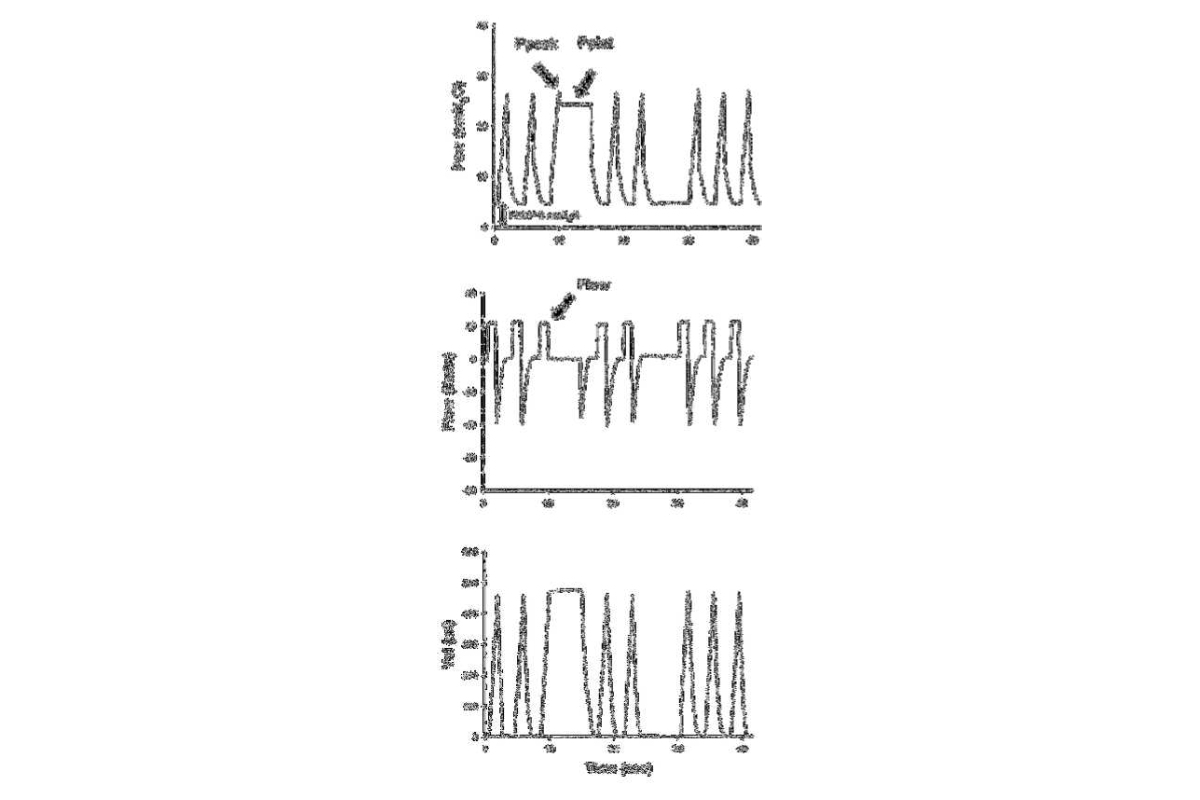
Trong quá trình thông khí kiểm soát thể tích với lưu lượng vuông ở bệnh nhân bị liệt, sức cản của hệ hô hấp (Rrs) có thể dễ dàng đo được trong quá trình tắc cuối thì hít vào (hình 2) bằng áp lực đỉnh đường thở (Ppeak) trừ Pplat chia cho lưu lượng hít vào (Φ):
Rrs = (Ppeak – Pplat)/Φ (Phương trình 2)
Trong quá trình thông khí hỗ trợ và kiểm soát áp lực, sức cản đường thở khó đo hơn và thường không được theo dõi thường xuyên.
Pesenti và cộng sự (Pesenti và cộng sự 1991) đã nghiên cứu tác động cấp tính của PEEP đối với sức cản hô hấp ở bệnh nhân ARDS. Họ đã nghiên cứu một nhóm bệnh nhân ARDS và so sánh họ với những bệnh nhân được gây mê bình thường.
Trong cả hai nhóm, họ đo độ đàn hồi (tương ứng của độ giãn nở) và sức cản ở ba mức PEEP (0, 5 và 10 cm H2O) ở những người bình thường và năm mức PEEP (0, 5, 10, 15, 20 cm H2O) trong nhóm ARDS. Xem xét sức cản đường hô hấp, họ phát hiện ra rằng Rrs ở nhóm ARDS cao hơn đáng kể so với các đối tượng đặt nội khí quản thông thường và nó thay đổi đáng kể với PEEP. Hơn nữa, các tác giả đã đo lường sự khác biệt giữa sức cản (ARrs) được đo ở cuối lưu lượng hít vào (Rrs tối thiểu) và sau khi đạt được mức P ổn định (Rrs tối đa):
ARrs = Rrs-max – Rrs-min (Phương trình 3)
Cần lưu ý rằng ARrs khác biệt đáng kể giữa các nhóm (bệnh nhân bình thường so với bệnh nhân ARDS) và nó tăng ở mức PEEP cao hơn. Hơn nữa, ở cả hai nhóm (bệnh nhân bình thường và ARDS), Rrs- max không giảm cho đến khi PEEP thấp hơn 10 cm H2O. Xem xét các kết quả này, các tác giả cho rằng Rrs-max phản ánh sự giảm căng thẳng của nhu mô và tính không đồng nhất theo hằng số thời gian giữa các đơn vị phổi, tức là giữa các đơn vị quá căng với hằng số thời gian ngắn và các đơn vị phổi xẹp với hằng số thời gian dài. Mức PEEP cao hơn có thể làm căng quá mức một số vùng phổi, làm tăng tính không đồng nhất của phổi. Điều này có thể xác định hiện tượng ‘pendelluft’ gia tăng ở mức PEEP cao với Rrs-max và ARrs tăng.
Pelosi và cộng sự (Pelosi và cộng sự 1995) đã xác nhận kết quả tương tự vài năm sau đó, khi đo Rrs- max và ARrs ở bệnh nhân ARDS nhẹ và nặng so với người bình thường. Họ phát hiện ra rằng Rrs-max tăng rõ rệt trong ARDS, chủ yếu do tăng sức cản hô hấp của phổi, trong khi sự đóng góp của sức cản thành ngực khá nhỏ. Đối với PEEP, họ phát hiện ra rằng mức PEEP tăng lên làm tăng đáng kể ARrs của phổi, dẫn đến Rrs -max của phổi tăng và Rrs -max không thay đổi của thành ngực. Xem xét kết quả này, vì ARrs sẽ phản ánh sự thích ứng với stress và sự bất bình đẳng của hằng số thời gian trong nhu mô phổi, họ suy đoán rằng PEEP có thể thay đổi đặc tính đàn hồi nhớt của phổi bằng cách làm căng quá mức các vùng phổi bị phồng lên, do đó làm tăng sức cản phổi tối đa và bổ sung.
Tuy nhiên, ở những bệnh nhân thở máy, Smith và Marini nhận thấy rằng PEEP lên tới 10 cm H2O có thể xác định mức giảm sức cản thở ra như được đề xuất bằng cách giảm áp lực đẩy, tăng độ giãn nở và lưu lượng thở ra không thay đổi. Một lời giải thích có thể là điều này xảy ra ở những bệnh nhân bị hạn chế lưu lượng thở ra do mức PEEP cao hơn (Smith và Marini 1988).
Eissa và cộng sự đã nghiên cứu ảnh hưởng của lưu lượng hít vào và thể tích bơm phồng lên các tính chất cơ học của hệ hô hấp của bệnh nhân ARDS so với người bình thường, bằng cách sử dụng kỹ thuật tắc nghẽn đường thở nhanh trong quá trình bơm phồng lưu lượng không đổi (Eissa và cộng sự 1991). Họ phát hiện ra rằng sức cản đường thở ở bệnh nhân ARDS cao hơn ở những tình nguyện viên bị liệt khỏe mạnh. Ở đối tượng bình thường, nó cũng giảm nhẹ nhưng đáng kể khi tăng thể tích. Họ cho rằng sự giảm sức cản luồng khí ở những người khỏe mạnh khi thể tích phổi tăng lên có thể xảy ra đồng thời với sự gia tăng đường kính đường thở.
Xem xét rằng sức đề kháng tăng lên có thể là do đáp ứng quá mức của đường thở thứ phát do viêm, Wright và cộng sự (Wright và cộng sự 1994) đã nghiên cứu khả năng đảo ngược của tình trạng tăng sức cản luồng khí ở bệnh nhân ARDS. Họ đã thiết kế một nghiên cứu chéo ngẫu nhiên, có đối chứng giả dược, trong đó bệnh nhân ARDS được dùng khí dung chứa chất chủ vận P2 hoặc giả dược. Họ phát hiện ra rằng chất chủ vận P2 dạng khí dung làm giảm đáng kể sức cản của luồng khí so với giá trị cơ bản và giá trị giả dược. Hơn nữa, chất chủ vận P2 làm tăng cả độ giãn nở phổi động và tĩnh. Vì vậy, họ cho rằng nó có thể giúp giảm nguy cơ chấn thương nhu mô phổi khi thở máy.
Tóm lại, tất cả các nghiên cứu được đề cập đều báo cáo rằng tổng sức đề kháng ở bệnh nhân ARDS tăng lên so với người bình thường. Mức PEEP thích hợp có thể làm giảm sức cản khi có hạn chế lưu lượng, nhưng ngược lại, mức PEEP cao (hơn 10 cm H2O) (Pesenti và cộng sự 1991, Pelosi và cộng sự 1995) và sự thay đổi lưu lượng và thể tích (Eissa và cộng sự 1991), có thể làm xấu đi đặc tính đàn hồi nhớt của phổi, làm tăng sức đề kháng. Tuy nhiên, ngay cả khi sức đề kháng hô hấp tăng ở bệnh nhân ARDS có thể được coi là dấu hiệu đặc trưng (của sự giảm độ giãn nở), sức đề kháng hiếm khi được đo lường và điều trị, không giống như các trường hợp bệnh phổi tắc nghẽn. Một cách tiếp cận đơn giản có thể là sử dụng thuốc giãn phế quản khi phát hiện thấy sức cản đường thở cao hơn, đặc biệt nếu sử dụng mức PEEP cao hơn 10 cm H2O.
Thể tích phổi cuối thì thở ra và PEEP
Dung tích cặn chức năng (functional residual capacity, FRC) là thể tích khí có trong phổi khi kết thúc thì thở ra thụ động. Khi áp dụng PEEP, FRC thường được đặt tên là thể tích phổi cuối thì thở ra (end expiratory lung volume, EELV). EELV là thể tích khí tối thiểu có trong phổi trong toàn bộ chu kỳ hô hấp mà thể tích khí lưu thông được thêm vào trong quá trình hít vào. EELV chủ yếu được xác định bởi sự cân bằng giữa lực đàn hồi của phổi và lực đối nghịch của thành ngực và PEEP được áp dụng. EELV là tổng của thể tích dự trữ thở ra (expiratory reserve volume), là thể tích khí tối đa có thể thở ra từ vị trí cuối thì thở ra, và thể tích cặn (residual volume), là thể tích khí còn lại trong phổi sau khi thở ra tối đa. Thể tích dự trữ thở ra có thể được đo thông qua phép đo phế dung trong khi việc đo thể tích cặn đòi hỏi các kỹ thuật như rửa trôi nitơ (nitrogen washout), pha loãng heli (helium dilution), đo thể tích cơ thể (body plethysmography) hoặc chụp CT.
EELV của nam giới người lớn có phổi khỏe mạnh thường trên 3000 ml khi áp dụng PEEP vài cm nước (Patroniti và cộng sự 2008). Ở phổi bị bệnh, EELV có thể giảm xuống giá trị thấp tới 500 ml (Patroniti và cộng sự 2010), điều này làm suy yếu nghiêm trọng chức năng trao đổi khí của phổi và Crs. Việc giảm EELV có thể chủ yếu là do xẹp phế nang, phù phổi kèm theo tràn ngập phế nang, viêm phổi hoặc giảm độ giãn nở của lồng ngực.
Các chiến lược thông khí hiện đại nhằm mục đích tối ưu hóa EELV để cải thiện quá trình trao đổi khí đồng thời ngăn ngừa VILI. EELV là thể tích khí chính góp phần trao đổi khí với máu. Nếu nhu mô phổi không còn được thông khí và làm giảm EELV, vẫn duy trì tưới máu thì máu tưới vào nhu mô đó sẽ không tham gia trao đổi khí. Do đó, shunt trong phổi tăng lên, dẫn đến thiếu oxy máu. May mắn thay, có những cơ chế làm giảm tưới máu phổi ở những vùng không được thông khí, chủ yếu là co mạch do thiếu oxy (hypoxic vasoconstriction), do đó làm giảm lượng shunt trong phổi. Nhưng các bệnh về phổi có thể làm thay đổi các cơ chế bảo vệ như vậy, do đó duy trì tỷ lệ shunt trong phổi tăng cao.
Số lượng phế nang được thông khí là yếu tố chính quyết định độ giãn nở của hệ hô hấp. Ví dụ, trong quá trình thông khí ở thể tích không đổi, việc giảm 50% số lượng phế nang được thông khí (xấp xỉ, như xảy ra trong quá trình thông khí một phổi) sẽ dẫn đến áp lực đẩy xấp xỉ gấp đôi. Do đó, EELV giảm có thể góp phần vào sự khởi phát hoặc duy trì VILI, vì thể tích khí lưu thông hít vào có thể được phân bổ trong một thể tích nhỏ hơn, dẫn đến chấn thương khí áp hoặc chấn thương thể tích có thể xảy ra.
Trong kỷ nguyên y học cá nhân hóa, việc đo EELV dường như là một kỹ thuật đầy hứa hẹn để đặt máy thở cơ học hợp lý và theo dõi tiến triển của bệnh phổi. Thật không may, cho đến gần đây, không có kỹ thuật đơn giản nào tại giường để đo EELV. Do đó, kỹ thuật đầy hứa hẹn này chưa bao giờ được đưa vào thực hành lâm sàng và do đó thiếu dữ liệu hỗ trợ việc sử dụng nó.
Thật vậy, trong 40 năm qua, chụp cắt lớp vi tính đã được sử dụng để đánh giá phổi bị bệnh (Gattinoni và cộng sự 1987). Chụp CT có thể được sử dụng để đo EELV, nhưng điều đó khiến bệnh nhân gặp nguy cơ về X quang và cũng yêu cầu bệnh nhân phải được chuyển đến cơ sở CT, kèm theo nguy cơ và chi phí.
EELV có thể được đo tại giường bằng cách sử dụng một trong nhiều kỹ thuật dựa trên sự pha loãng của khí đánh dấu (Patroniti và cộng sự 2004, Chiumello và cộng sự 2008). Một số kỹ thuật này yêu cầu thông khí cho bệnh nhân bằng một hệ thống khép kín có thể tích và nồng độ cơ bản đã biết của khí trơ, thường là heli (kỹ thuật thở lại). Trong khoảng thời gian vài hơi thở, bằng cách đo sự hòa trộn cuối cùng của khí trơ đánh dấu, có thể tính toán EELV. Kỹ thuật này, được áp dụng ở những bệnh nhân thở máy, yêu cầu ngừng thông khí cơ bản hoặc điều chỉnh phức tạp hệ thống thở để duy trì thông khí cơ bản trong quá trình đo.
Các kỹ thuật khác, sử dụng mạch hở (kỹ thuật không thở lại), đo EELV bằng cách thay đổi nồng độ hít vào của khí được sử dụng làm chất đánh dấu (oxy hoặc nitơ hoặc khí trơ như heli hoặc lưu huỳnh hexafluoride SF6) và đo lượng lượng khí cần thiết để đạt được trạng thái cân bằng mới (Richard và Guerin 2013). Một số kỹ thuật này đòi hỏi máy phân tích khí nhanh và nhạy cũng như sự đồng bộ chính xác giữa nồng độ khí và tín hiệu lưu lượng đường thở, hiện nay (nhờ công nghệ cải tiến) được triển khai trong máy thở và máy theo dõi cơ học có bán trên thị trường. Bằng cách thay đổi nồng độ oxy hít vào, các thiết bị này có thể đưa ra thước đo EELV đáng tin cậy, đặc biệt là trong quá trình thở máy kiểm soát. Người ta hy vọng rằng những thiết bị mới này có thể dẫn đến việc phổ biến phép đo EELV rộng rãi hơn và sẽ giúp làm rõ vai trò lâm sàng của phép đo EELV.
Như đã đề cập trước đó, EELV giảm khi có ARDS, như được mô tả trong khái niệm ‘phổi trẻ em’ được giới thiệu vào giữa những năm 1980 (Gattinoni và Pesenti 2005). Kết quả kiểm tra CT đầu tiên ở bệnh nhân người lớn mắc ARDS cho thấy nhu mô phổi không đồng nhất với mô phổi được thông khí ước tính có kích thước bằng một em bé khỏe mạnh. Vì các đặc tính cơ học của phổi thông khí gần như bình thường, độ giãn nở của hệ hô hấp, với sự hiện diện của độ giãn nở thành ngực bình thường, phản ánh tốt thể tích của phổi được thông khí (EELV nếu được đo ở cuối thì thở ra).
Sau đó, người ta cũng phát hiện ra rằng nhu mô thông khí chủ yếu nằm ở những vùng không phụ thuộc của khoang ngực. Những dữ liệu này đã giúp phát triển khái niệm về phổi ‘bọt biển’, điều này cho thấy rằng phổi bị bệnh có khả năng thẩm thấu bị suy giảm dẫn đến phù nề kẽ. Trọng lượng phổi tăng lên gây ra sự sụp đổ của các vùng phụ thuộc, trừ khi áp lực đường thở (tức là PEEP) cao hơn áp lực chồng chất được áp dụng. Mô hình phổi xốp dường như có thể áp dụng cho những bệnh nhân mắc ARDS có nguồn gốc ngoài phổi (như nhiễm trùng huyết), trong khi phù nề mô kẽ dường như nằm không đồng nhất hơn ở ARDS có nguồn gốc từ phổi (như viêm phổi).
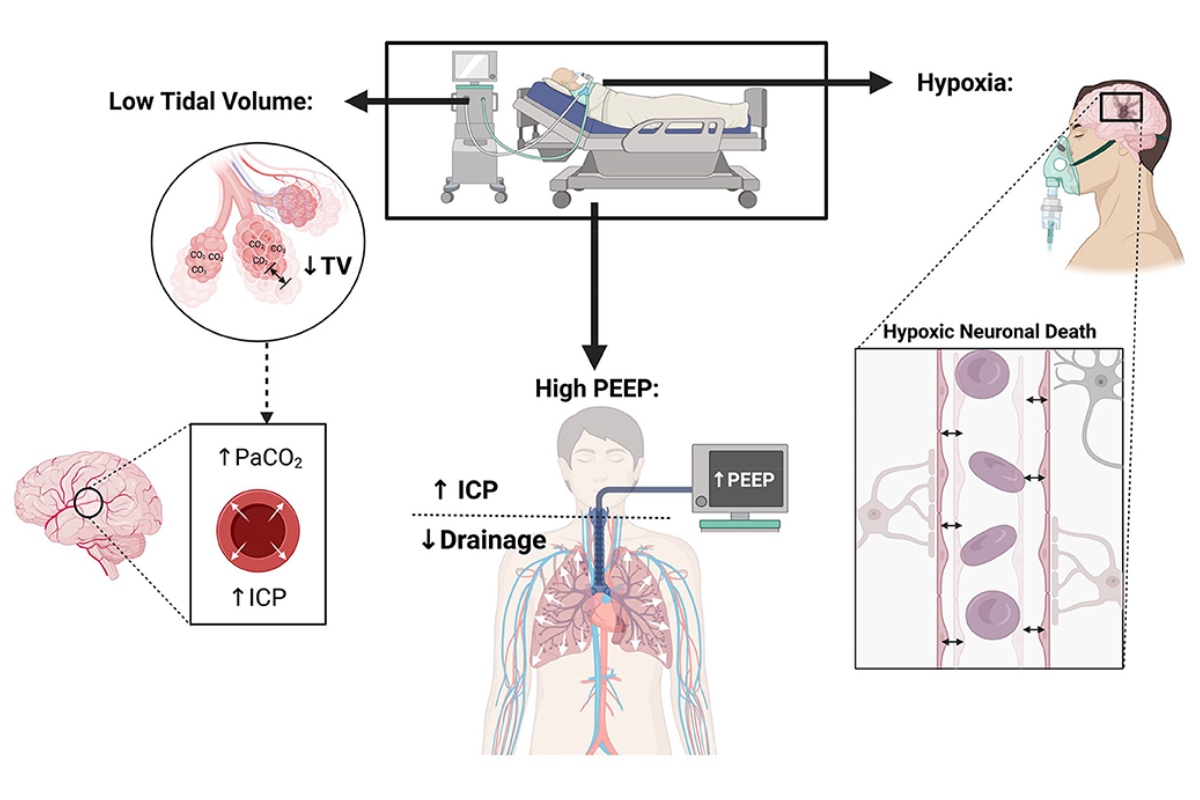
Chiến lược thông khí hiện tại nhằm mục đích ngăn chặn việc giảm EELV bằng cách ngăn ngừa xẹp phổi thông qua việc áp dụng áp lực thích hợp (PEEP). Tuy nhiên, một khi các phế nang không được phục hồi, để mở chúng ra, cần phải tạo áp lực cao hơn mức cần thiết chỉ để giữ cho chúng mở. Áp lực huy động như vậy có thể lên tới 45 cm H2O (thao tác huy động). Bằng cách huy động hiệu quả và mức PEEP thích hợp, có thể giảm thiểu shunt trong phổi, do đó tối đa hóa các đặc tính oxygen hóa của phổi bị bệnh. Hơn nữa, phổi được huy động có EELV cao hơn và do đó thể tích khí lưu thông sau đó sẽ được phân bổ ở số lượng phế nang cao hơn (tức là tỷ lệ Vt/EELVthấp hơn), làm giảm nguy cơ mắc VILI (Bellani và cộng sự 2011). Ngược lại, PEEP quá cao có thể tạo điều kiện thuận lợi cho VILI khởi phát do gây ra tình trạng căng quá mức (hình 1).
Trong khi chọn PEEP, điều quan trọng là phải đánh giá tình trạng thể tích của bệnh nhân, vì PEEP cao hơn có thể làm tăng áp lực trong lồng ngực và có tác động tiêu cực đến cung lượng tim của bệnh nhân. Do đó, trong giai đoạn cấp tính của suy hô hấp, khi cần mức PEEP đáng kể, thông thường cần đạt được cân bằng dịch dương để duy trì cung cấp đủ oxy. Khi độ giãn nở và oxygen hóa được cải thiện và PEEP có thể được hạ xuống, cân bằng dịch âm có thể được mong muốn. Mức PEEP tối ưu sẽ tìm kiếm sự cân bằng hợp lý giữa mục tiêu oxygen hóa, phòng ngừa VILI và ổn định huyết động.
Huy động phế nang
Ở mức PEEP không đổi và trong điều kiện trạng thái ổn định, việc áp dụng thủ thuật huy động có thể gây ra sự gia tăng EELV (nếu có thể tích phổi có thể huy động được), điều này chủ yếu là do sự gia tăng số lượng phế nang được thông khí. Điều này thể hiện một phương pháp chính xác để đánh giá việc huy động phế nang. Trong tình trạng này, nếu không có phép đo EELV, chúng tôi có thể mong đợi sự gia tăng oxygen hóa và độ giãn nở hệ hô hấp (tức là tăng thể tích khí lưu thông khi thông khí áp lực không đổi hoặc giảm áp lực đẩy khi thông khí thể tích không đổi). Sự thanh thải CO2 được cải thiện có thể được ghi nhận nhưng không phải lúc nào cũng có.
Đánh giá việc huy động phổi ở các mức PEEP khác nhau khó khăn hơn. Sự gia tăng PEEP (và sự gia tăng áp lực cao nguyên liên quan) thường dẫn đến tăng EELV, nhưng EELV cao hơn như vậy có thể chỉ là do sự gia tăng độ căng của các phế nang đã mở trước đó (nơi không xảy ra huy động) hoặc sự kết hợp của sự căng phồng của các phế nang đã mở trước đó của phế nang đã mở trước đó cộng với việc huy động và mở rộng các phế nang bị xẹp trước đó (xảy ra huy động). Cần phải phân biệt giữa hai tình huống này để tối ưu hóa cài đặt máy thở. Nhiều chiến lược có thể được sử dụng để đánh giá việc huy động phổi, mỗi chiến lược đo lường các khía cạnh cụ thể của việc huy động phế nang. Chụp cắt lớp vi tính có thể cho thấy lượng mô phổi chuyển từ trạng thái không thông khí sang trạng thái thông khí (hình 3).
CT khiến bệnh nhân gặp phải những nguy cơ và bất tiện được liệt kê ở trên. Cần ít nhất hai lần quét và nó yêu cầu phân tích hình ảnh khá phức tạp, chưa được chuẩn hóa.
Siêu âm phổi (Lichtenstein 2014) là một công cụ động học không xâm lấn được áp dụng tại giường bệnh. Học kỹ thuật này cần có thời gian nhưng nó đang chứng tỏ là một công cụ đáng tin cậy, hữu ích để chẩn đoán sự hiện diện của xẹp phổi, xác định áp lực đóng mở và đánh giá huyết động.

Bằng cách đo EELV ở hai mức PEEP và độ giãn nở của hệ hô hấp ở PEEP thấp hơn, có thể ước tính thể tích được huy động. Giả sử không có sự huy động phổi, mức độ độ giãn nở ở mức PEEP thấp hơn và cao hơn sẽ tương tự nhau (nếu không xảy ra tình trạng phổi quá căng). Do đó, EELV ở mức PEEP cao hơn có thể được tính toán dễ dàng (EELV ở PEEP thấp cộng với độ giãn nở nhân với chênh lệch áp lực giữa PEEP thấp và cao) và nó phải tương tự với EELV đo được ở PEEP cao hơn. Nếu EELV ở mức PEEP cao đo được cao hơn con số tính toán, người ta có thể suy đoán rằng việc huy động phổi đã xảy ra.
Tương tự, việc huy động cũng có thể được đo lường bằng sự chênh lệch về thể tích giữa hai đường cong P/V được đo ở các mức PEEP ban đầu khác nhau (Maggiore và cộng sự 2003). Hình dạng đường cong P/V hít vào có thể cung cấp thông tin về khả năng huy động của phổi. Một đường cong có độ lõm hướng lên trên, xác định điểm uốn (thường được đặt tên là điểm uốn dưới) và sự hiện diện của độ trễ trong đường cong bơm phồng-xẹp xuống gợi ý phổi có thể huy động được. Phương pháp tiêu chuẩn sử dụng đường cong P/V vẫn còn được tranh luận.
Ngoài ra, EIT có thể được sử dụng để ước tính việc huy động phổi bằng cách đánh giá sự thay đổi trong các giá trị trở kháng cuối thì thở ra ở các mức PEEP khác nhau hoặc những thay đổi về tính đồng nhất (xem bên dưới) (Frerichs và cộng sự 2017).
Huy động phế nang giảm thiểu strain cho phổi. Do đó, đo nó tại giường để hướng dẫn cài đặt thông khí có thể là một chiến lược lâm sàng hiệu quả để cải thiện kết quả ARDS.
Áp lực cao nguyên
Phương trình chuyển động của hệ hô hấp cho biết áp lực tác dụng lên hệ thống (Prs) trong quá trình thông khí là tổng áp lực do máy thở tạo ra (được đo tại cửa mở đường thở, Paw) và áp lực do cơ hô hấp tạo ra (Pmus); áp lực này là cần thiết để vượt qua sức cản đường thở và tạo ra luồng không khí (Pres) và vượt qua lực đàn hồi (Pel) (Lucangelo và cộng sự 2005). Trong quá trình thở máy có kiểm soát, Pmus bằng 0 và phương trình chuyển động trở thành
Prs = Paw + Pmus = Pres + Pel + PEEP = (Φ X Rrs) +
(Vt X Ers) + PEEP (Phương trình 4)
trong đó Rrs là sức cản đường thở, Vt là thể tích khí lưu thông và Ers là độ đàn hồi của hệ hô hấp. Pplat là áp lực được đo tại cửa đường thở ở cuối thì hít vào trong điều kiện tĩnh (tức là không có luồng khí), sau khi cân bằng hoàn toàn giữa áp lực phế nang và đường thở. Khi không có lưu lượng khí, Pres bằng 0 và áp lực phế nang và đường thở bằng nhau. Trong những điều kiện này, Pplat phản ánh áp lực đàn hồi của toàn bộ hệ hô hấp (Lucangelo và cộng sự 2005). Pplat được đo trong quá trình tắc cuối thì hít vào, chỉ bằng cách nhấn nút ‘giữ thì hít vào’ (inspiratory hold) có sẵn trên tất cả các máy thở ICU có bán trên thị trường. Trong thời gian tạm dừng, lưu lượng giảm xuống 0, thể tích bị giữ lại bên trong phổi và áp lực tĩnh của đường thở được đo. Điều quan trọng là phải thực hiện tắc ít nhất 2 giây để cho phép cân bằng áp lực trong phế nang với các hằng số thời gian khác nhau.
Điều này đúng cho cả thông khí kiểm soát thể tích (VCV) và thông khí kiểm soát áp lực (PCV). Đáng chú ý là trong PCV, Pplat được đo bằng tắc nghẽn cuối thì hít vào có thể khác biệt đáng kể so với giá trị cài đặt của áp lực hít vào.
Cuối cùng, Pplat cũng có thể được đo trong quá trình thông khí hỗ trợ áp lực (PSV), một chế độ thông khí hỗ trợ. Trong trường hợp này, Pmus không bằng 0 vì cơ hít vào của bệnh nhân tạo ra một lượng áp lực nhất định và bệnh nhân và máy thở sẽ chia sẻ công thở. Trong quá trình thực hiện thao tác tắc cuối thì hít vào, nếu bệnh nhân thư giãn các cơ hít vào, có thể xác định được một cao nguyên ổn định trên đường theo dõi áp lực đường thở. Giống như trong quá trình thông khí cơ học có kiểm soát, điều này thể hiện áp lực đàn hồi của hệ thống. Giá trị của Pplat này có thể cao hơn, bằng hoặc thấp hơn áp lực do máy thở cung cấp (là tổng của PS + PEEP); sự khác biệt được gọi là chỉ số Pmus (PMI) và tương ứng với áp lực được tạo ra bởi các cơ hô hấp ở cuối thì hít vào (Foti và cộng sự 1997). Tuy nhiên, thực hiện thao tác tắc cuối thì hít vào ở bệnh nhân thở tự nhiên đòi hỏi phải ngừng hoàn toàn bất kỳ nỗ lực hít vào nào trong quá trình thao tác. Nếu không thể xác định được điểm ổn định thì giá trị đó không đáng tin cậy và thao tác phải được lặp lại.
Giám sát Pplat trong quá trình thở máy là cực kỳ quan trọng vì ít nhất hai lý do.
Đầu tiên, cần đánh giá tính chất đàn hồi của hệ hô hấp và tính toán độ giãn nở của hệ thống (Crs). Người ta biết rằng Crs ở bệnh nhân ARDS có liên quan trực tiếp đến kích thước của ‘phổi trẻ em’ (phần nhu mô phổi có thể thông khí), do đó liên quan đến mức độ nghiêm trọng của bệnh.
Thứ hai, vì trong điều kiện tĩnh, áp lực đường thở và phế nang ở trạng thái cân bằng, Pplat được coi là ước tính đáng tin cậy về áp lực làm căng phổi và do đó là mức độ stress phổi, một yếu tố quyết định chính của VILI.
Điều này đã được chứng minh rõ ràng bằng thử nghiệm ARMA, trong đó 861 bệnh nhân ARDS được chọn ngẫu nhiên để thông khí Vt thấp (6 ml/kg trọng lượng cơ thể dự đoán hoặc điều chỉnh để giữ Pplat thấp hơn 30 cm H2O) hoặc đến Vt ‘truyền thống’ (12 ml/kg hoặc Pplat thấp hơn 50 cm H2O). Những bệnh nhân trong nhóm Vt thấp – Pplat thấp có tỷ lệ tử vong thấp hơn đáng kể (31% so với 40%, p = 0,007) (ARDSnet 2000). Dựa trên những kết quả này, việc hạn chế Vt và giữ Pplat ở mức < 30 cmH2O vẫn được coi là nền tảng của chiến lược thông khí cho bệnh nhân ARDS.
Tuy nhiên, ngưỡng 30 cmH2O vẫn đang được tranh luận. Terragni và cộng sự sử dụng hình ảnh quét CT (Terragni và cộng sự 2007) và Bellani và cộng sự sử dụng phương pháp chụp cắt lớp phát xạ positron (Bellani và cộng sự 2011) đã chứng minh rằng tình trạng siêu bơm phồng theo chu kỳ thở và viêm phổi có thể được phát hiện ở một tỷ lệ đáng kể bệnh nhân, mặc dù sử dụng Vt và Pplat ‘bảo vệ’. Dựa trên những quan sát này, một số chuyên gia đề xuất mục tiêu Pplat thấp hơn (thường thấp hơn 27 cm H2O). Hạn chế chính của việc sử dụng Pplat làm đại diện thô cho stress phổi phụ thuộc vào thực tế là áp lực căng phổi thực sự không phải là áp lực tĩnh của đường thở (phế nang) mà là áp lực xuyên phổi (được thảo luận trong đoạn sau), có tính đến sự thay đổi áp lực màng phổi do độ đàn hồi của thành ngực. Trong thực tế, giá trị Pplat là 30 cm H2O có thể ước tính quá mức hoặc thấp hơn mức stress phổi ở những bệnh nhân có các đặc tính cơ học của phổi và thành ngực khác nhau.
Áp lực đẩy
Trong quá trình thở máy, áp lực đẩy đường thở qua hệ thống hô hấp (APrs) được định nghĩa là áp lực do máy thở cung cấp để bơm phồng hệ thống. APrs bằng sự thay đổi áp lực theo chu kỳ thở giữa tổng PEEP (PEEPtot, tổng PEEP bên ngoài + PEEP nội tại) và Pplat cuối thì hít vào:
APrs = Pplat – PEEPtot (Phương trình 5)
Ở đây, APrs phải được tính trong điều kiện tĩnh (không có lưu lượng), bằng cách tạm dừng cuối thì hít vào và tạm dừng cuối thì thở ra. Nó có thể dễ dàng được đo tại giường ở những bệnh nhân không nỗ lực hô hấp.
Gần đây, nhiều tác giả đã khẳng định rằng, ở những bệnh nhân mắc ARDS, APrs có thể được coi là đại diện thay thế tốt nhất để đánh giá mức độ stress và strain của phổi tại giường bệnh (Amato và cộng sự 2015). Vì lý do này, việc giảm APrs đã được đề xuất như một biện pháp để giảm nguy cơ VILI. Khái niệm thông khí bảo vệ phổi dựa trên việc áp dụng Vt thấp hơn, Pplat thấp hơn và mức PEEP cao hơn, để giảm lượng năng lượng bên ngoài tác động vào phổi, chủ yếu là do stress và strain động gây ra bởi bơm khí theo chu kỳ thở (Slutsky và Ranieri 2013). Để đạt được mục đích này, Vt nên được điều chỉnh theo tỷ lệ của phổi có sẵn để thông khí, tương ứng với thể tích phổi cuối thì thở ra (EELV) và được biết là giảm đáng kể ở bệnh nhân ARDS (“phổi trẻ em”). Vì các biện pháp đo EELV không được thực hiện thường xuyên nên không nên vượt quá giới hạn Vt là 6 ml/kg trọng lượng cơ thể lý tưởng (IBW). Tuy nhiên, việc chia tỷ lệ Vt theo IBW không phản ánh chính xác lượng mô phổi được thông khí và không liên quan đến stress phổi.
Ngược lại, độ giãn nở của hệ hô hấp có liên quan tuyến tính với kích thước của ‘phổi trẻ em’ (Gattinoni và Pesenti 2005). Vì APrs theo chu kỳ thở bằng tỷ số giữa Vt và Crs theo phương trình:
APrs = Vt/Crs (Phương trình 6)
nó có thể được xem như một cách để bình thường hóa Vt để phổi có khả năng chấp nhận nó, từ đó tích hợp hai yếu tố chính của stress cơ học. Vì lý do này, việc giới hạn APrs có thể là cách tốt hơn để chuẩn độ Vt theo kích thước thực tế của phổi được thông khí, do đó làm giảm stress và strain ở phổi và có thể cải thiện kết quả của bệnh nhân.
Trong một thử nghiệm hồi cứu quan trọng gần đây, Amato và cộng sự đã phân tích tác động của APrs đối với khả năng sống sót của bệnh nhân ARDS. Họ đã xem xét dữ liệu riêng lẻ từ 3562 bệnh nhân mắc ARDS đăng ký trong 9 thử nghiệm ngẫu nhiên và thực hiện phân tích hòa giải để ước tính tác động của những thay đổi APrs do cài đặt máy thở khác nhau. APrs là biến số thông khí có mối liên hệ chặt chẽ nhất với khả năng sống sót; nguy cơ tử vong tương đối tăng đáng kể trên ngưỡng APrs là 14 cm H2O, ngay cả ở những bệnh nhân được thở máy với Vt và Pplat ‘bảo vệ’. Điều thú vị là, ở những bệnh nhân có Pplat cao hơn, tỷ lệ tử vong chỉ tăng khi giá trị Pplat cao có liên quan đến APrs cao hơn; tương tự, mức PEEP cao hơn chỉ có tác dụng bảo vệ khi kết hợp với APrs thấp. Cuối cùng, ở mức Pplat không đổi, Vt thấp hơn là một yếu tố dự báo khả năng sống sót mạnh mẽ khi được chuẩn hóa thành Crs (tức là APrs) chứ không phải theo IBW (Amato và cộng sự 2015).
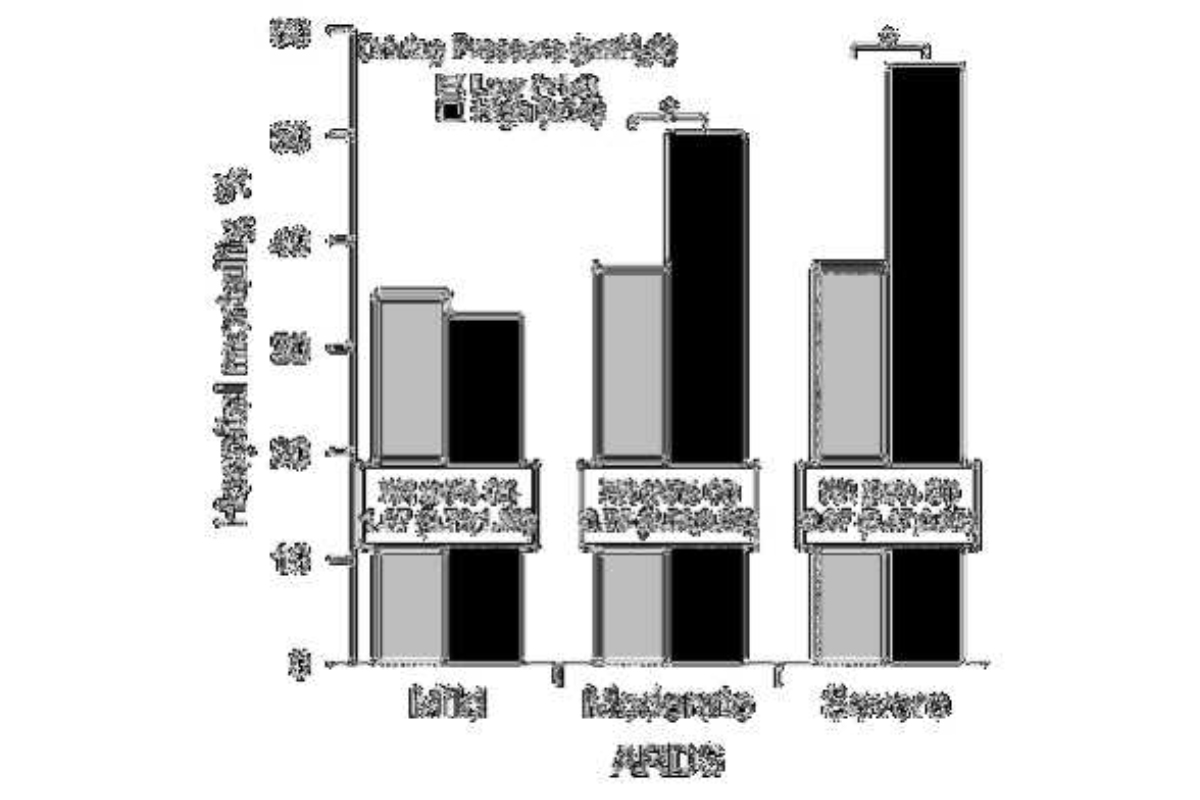
Ngoài ra, nghiên cứu về Lung Safe được công bố gần đây đã xác nhận giá trị tiên lượng mạnh mẽ của APrs, với tỷ lệ tử vong tăng theo APrs (Bellani và cộng sự 2016a, Laffey và cộng sự 2016) (hình 4).
Guerin và cộng sự đã báo cáo tác dụng tương tự đối với khả năng sống sót, họ đã xem xét lại dữ liệu từ hai nghiên cứu ngẫu nhiên lớn trên 787 bệnh nhân ARDS, trong đó Vt và Pplat được duy trì nghiêm ngặt trong giới hạn ‘an toàn’ là 6 ml/kg và tương ứng là 30 cm H2O. Họ tìm thấy mối liên hệ đáng kể giữa APrs và tỷ lệ tử vong, quan sát thấy nguy cơ tử vong tăng 5% đối với mỗi 1 cm H2O tăng trong APrs và tỷ lệ tử vong giảm đáng kể khi APrs thấp hơn 13 cmH2O (Guerin và cộng sự 2016). Tuy nhiên, khác với nghiên cứu của Amato, APrs không vượt trội hơn Pplat, Vt và Crs như một yếu tố dự báo tử vong và các tác giả kết luận rằng khi cài đặt máy thở bảo vệ được áp dụng nghiêm ngặt, APrs có cùng thông tin tiên lượng như Pplat và Crs.
Một hạn chế cố hữu của khái niệm áp lực đẩy đường thở nằm ở chỗ nó thể hiện sự thay đổi áp lực trên toàn bộ hệ hô hấp, bao gồm hai cấu trúc nối tiếp nhau là phổi và thành ngực. Như chúng ta đã thấy trong đoạn trước, phần APrs được sử dụng để mở rộng phổi và thành ngực phụ thuộc vào độ giãn nở tương đối của chúng (hoặc độ đàn hồi).
Do đó, áp lực đẩy xuyên phổi (APl) sẽ phản ánh căng thẳng của phổi tốt hơn so với áp lực đẩy đường thở. Ví dụ, ở một bệnh nhân có độ giãn nở phổi bình thường (Cl) nhưng độ giãn nở thành ngực rất thấp (Ccw), một Vt nhất định có thể tạo ra APrs cao nhưng APl thấp và do đó áp lực phổi thấp.
APl là chênh lệch giữa giá trị tĩnh của đường thở dẫn động và áp lực màng phổi, với áp lực màng phổi được ước tính bằng áp lực thực quản (Pes):
APl = (Pplat – end inspiratory Pes) – ( PEEPtot – end expiratory Pes) (Phương trình 7)
Để đánh giá sự khác biệt giữa APrs và APl, Cortes-Puentes và cộng sự (2015) đã thực hiện một nghiên cứu thực nghiệm gây ra những biến đổi có thể đảo ngược của Ccw ở động vật có các bệnh lý phổi khác nhau. Đúng như dự đoán, họ phát hiện ra rằng APrs bị ảnh hưởng đáng kể bởi những thay đổi trong Ccw và bởi các đặc tính cơ bản của phổi.
Tuy nhiên, Chiumello và cộng sự gần đây đã đo APrs, APl, stress phổi và độ giãn nở phân vùng ở 150 bệnh nhân ARDS ở hai mức PEEP (Chiumello và cộng sự 2016). Ở cả hai mức PEEP, APrs cho thấy mối tương quan đáng kể với APl. Hơn nữa, những bệnh nhân có APrs cao hơn có áp lực phổi cao hơn đáng kể và APrs trên 15 cm H2O đã phát hiện chính xác áp lực phổi vượt quá 24 cm H2O.
Áp lực đẩy đường thở và xuyên phổi là những biện pháp đầy hứa hẹn để xác định bệnh nhân có nguy cơ mắc VILI, do mối tương quan của chúng với kết cục của bệnh nhân. Tuy nhiên, vai trò của chúng như là mục tiêu điều trị để điều chỉnh cài đặt thở máy vẫn chưa rõ ràng và cần được đánh giá trong các nghiên cứu ngẫu nhiên tiền cứu.
Áp lực xuyên phổi
Thuật ngữ “áp lực xuyên thành” dùng để chỉ áp lực bên trong một ngăn so với bên ngoài. Trong các kết cấu rỗng, áp lực xuyên thành là áp lực xuyên qua các bức tường của kết cấu và trong điều kiện tĩnh, bằng áp lực đàn hồi của khoang. Áp lực xuyên thành của phổi là áp lực xuyên phổi (Pl). Vì áp lực bên trong phổi là áp lực đường thở (áp lực khi mở đường thở, Paw) và áp lực xung quanh phổi là áp lực màng phổi (Ppl) (Sahetya và Brower 2016):
Pl = Paw – Ppl (Phương trình 8)
Ở đây, Pl có thể được chia thành hai phần: áp lực cần thiết để vượt qua sức cản đường thở và tạo ra luồng không khí giữa cửa đường thở và phế nang (áp lực sức cản), và áp lực cần thiết để mở rộng khoang phế nang (do tính đàn hồi của phế nang và được gọi là áp lực xuyên phế nang;) (Bellani và cộng sự 2016b). Áp lực xuyên phế nang là áp lực xuyên qua thành phế nang và thể hiện áp lực thực tế tác động lên phổi trong quá trình thông khí. Nó bằng sự chênh lệch giữa áp lực phế nang và màng phổi:
PLel = Paiv – Ppl (Phương trình 9)
Tuy nhiên, trong điều kiện tĩnh (tức là lưu lượng khí bằng 0), áp lực đường thở và phế nang ở trạng thái cân bằng và áp lực xuyên phổi và xuyên phế nang gần như trùng khớp. Ngược lại, trong điều kiện động, áp lực tại cửa đường thở và áp lực phế nang không giống nhau, do giảm áp lực sức cản.
Bây giờ cần phải rõ ràng rằng áp lực xuyên phổi (chứ không phải áp lực đường thở) là áp lực ‘thực’ làm căng phổi, gây stress phổi và VILI, và cài đặt thông khí cơ học phải được điều chỉnh để đạt được các giá trị ‘an toàn’ của Pl thay vì của Paw. Vì hệ thống hô hấp bao gồm hai cấu trúc đàn hồi nối tiếp nhau là phổi và thành ngực nên áp lực tác động lên cửa thông khí được sử dụng một phần để làm phồng phổi và một phần để mở rộng thành ngực theo độ giãn nở tương đối của chúng (hoặc độ đàn hồi) (xem bên dưới). Do đó, áp lực xuyên phổi và áp lực đường thở có thể khác nhau đáng kể khi có bất thường ở thành ngực gây ra giá trị áp lực màng phổi tăng cao. Nói cách khác, cùng một Pplat 30 cm H2O có thể không gây tổn thương ở bệnh nhân có độ giãn nở phổi tương đối bình thường nhưng thành ngực rất cứng hoặc gây chấn thương sinh học cao ở bệnh nhân có phổi cứng và độ giãn nở thành ngực bình thường (Mauri và cộng sự 2016).
Thật không may, không có kỹ thuật đơn giản và an toàn nào cho phép đo trực tiếp Ppl và phương pháp phổ biến nhất được sử dụng để ước tính nó tại giường bệnh là đo áp lực thực quản. Áp lực được đo bằng một ống thông được trang bị một quả bóng dài có thành mỏng chứa đầy không khí đặt ở phần dưới của thực quản (Pes) thường được coi là đại diện hợp lý cho Ppl trung bình bao quanh phổi ở tư thế thẳng đứng, đối tượng khỏe mạnh (hình 5).
Tuy nhiên, độ tin cậy của Pes khi ước tính Ppl ở bệnh nhân nằm ngửa, thở máy là vấn đề đáng nghi ngờ do có thể có một số nguồn sai sót (Mauri và cộng sự 2016). Một số nghiên cứu đã đánh giá Pl là mục tiêu cho thở máy. Nghiên cứu phù hợp nhất được thực hiện bởi Talmor và cộng sự ở 61 bệnh nhân mắc ARDS được chỉ định ngẫu nhiên thở máy với peep được điều chỉnh dựa trên phép đo Pes hoặc trên bảng PEEP-FiO2 từ khuyến nghị của Mạng lưới ARDS (Talmor và cộng sự 2008). Pl được đánh giá bằng phương pháp ‘tính toán trực tiếp’, tức là bằng cách trừ giá trị tuyệt đối của Pes cho áp lực đo được tại cửa đường thở (Pl =Paw -Pes). Trong nhóm được hướng dẫn bằng Pes, peep đã được chuẩn độ để đạt được giá trị dương của Pl cuối thì thở ra, trong khi duy trì Pl cuối thì hít vào thấp hơn 25 cm H2O; khác nhau, bệnh nhân đối chứng thường có giá trị Pl cuối kỳ thở ra âm tính. Bệnh nhân trong nhóm can thiệp có mức peep cao hơn đáng kể liên quan đến sự cải thiện đáng kể về oxygen hóa và độ giãn nở của phổi.
Do độ tin cậy không chắc chắn của các giá trị Pes tuyệt đối khi ước tính Ppl thực tế, một số tác giả đã đề xuất sử dụng phương pháp ‘dựa trên độ đàn hồi’ (Chiumello và cộng sự 2016) để tính Pl thay vì phương pháp tính trực tiếp được sử dụng bởi Talmor.
Phương pháp này không dựa trên các giá trị Pes tuyệt đối mà sử dụng các biến thể Pes theo chu kỳ thở để tính toán độ đàn hồi của thành ngực:
Ecw = APes/Vt (Phương trình 10)
Như đã giải thích ở trên, áp lực tại cửa đường thở là tổng áp lực cần thiết để làm phồng phổi (Pl) và áp lực cần thiết để giãn nở thành ngực (Pcw):
Paw = Pl + Pcw (Phương trình 11)
Vì sự thay đổi về thể tích của phổi và thành ngực là như nhau nên phương trình có thể được viết là
Paw/Vt = Pl/Ví + Pcw/Vt (Phương trình 12)
Vì độ đàn hồi của hệ hô hấp (Ers) = Paw/Vt và độ đàn hồi của phổi (El) = Pl/Ví, phương trình có thể được viết là
Pl = Paw x (EL/Ers) (Phương trình 13)
Grasso và cộng sự đã áp dụng phương pháp này trong một nhóm nhỏ gồm 14 bệnh nhân mắc cúm A được chuyển đến ECMO, trong đó PEEP được chuẩn độ để nhắm mục tiêu Pl cuối thì hít vào là 25 cm H2O, được coi là giới hạn sinh lý trên (Grasso và cộng sự 2012).
Gulati và cộng sự đã so sánh hồi cứu phép đo Pes trực tiếp và các phương pháp bắt nguồn từ độ đàn hồi để ước tính Ppl ở 64 bệnh nhân ARDS. Hai phương pháp không tương quan, đưa ra ước tính Ppl khác nhau khoảng 10 cm H2O đối với một bệnh nhân nhất định. Họ cũng so sánh hai chiến lược tối ưu hóa PEEP (tức là nhắm mục tiêu Pl cuối kỳ thở ra dương tính bằng cách sử dụng các giá trị Pes tuyệt đối so với
Mauri 2017 Respiratory mechanics to understand ARDS nhắm mục tiêu Pl cuối thì hít vào là 25 cm H2O bằng phương pháp có nguồn gốc từ độ đàn hồi) và một lần nữa nhận thấy sự trái ngược đáng kể. và các kết quả không liên quan (Gulati và cộng sự 2013). Nói chung, chúng tôi có thể đưa ra giả thuyết rằng sự bất bình đẳng về giá trị Ppl trên ngực có thể dẫn đến những khác biệt này.
Tính không đồng nhất
Phổi khỏe mạnh là phổi đồng nhất; vào cuối thì thở ra, phổi không xẹp xuống và phổi có vẻ nở ra đồng đều. Sau đó, trong quá trình hít vào, các lực làm căng nhu mô để tạo ra áp lực phế nang âm và luồng khí hít vào được phân bố đồng nhất trong các cấu trúc có đặc tính cơ học tương tự trên một đơn vị mô, mang lại sự giãn nở đồng đều. Trong ARDS, trọng lượng phổi tăng do tổn thương phù nề gây ra sự sụp đổ cấu trúc phế nang. Xẹp, hầu hết xảy ra ở các vùng phổi phụ thuộc (tức là xẹp lưng).
Tuy nhiên, sự sụp đổ của các vùng không phụ thuộc nằm ở vị trí phía trên các đơn vị được thông khí tốt cũng là điều phổ biến, có thể do sự phân bố không đồng nhất của các cytokine và tế bào gây viêm. Gần đây, tính không đồng nhất này ngày càng được công nhận là một chỉ số liên quan về mức độ nghiêm trọng của ARDS cũng như là yếu tố chính quyết định VILI, với hai khái niệm này có thể có mối liên hệ chặt chẽ với nhau (Cressoni 2014).
Một số nhầm lẫn nảy sinh do tính không đồng nhất trong các nghiên cứu được công bố đã được gọi chung là tính không đồng nhất của thông khí tĩnh cuối kỳ thở ra và tính không đồng nhất của thông khí hít vào động. Đầu tiên đề cập đến sự phân bố không đồng nhất của các vùng phổi được thông khí và xẹp trong phổi ARDS ở cuối thì thở ra; nó thường được đánh giá bằng chụp CT và nó thể hiện một bức tranh tĩnh về kiểu hình ARDS cụ thể (Cressoni và cộng sự 2014). Mối tương quan đã được chứng minh của biện pháp này với mức độ nghiêm trọng lâm sàng của ARDS có thể xuất phát từ thực tế là sự không đồng nhất về thông khí gây ra sự không đồng nhất về thông khí. Thật vậy, một nghiên cứu trên mô hình ARDS động vật đã chỉ ra rằng sự đồng nhất ở cuối thì hít vào với những thay đổi nhỏ so với thể tích giãn nở trung bình của các đơn vị phế nang chỉ đạt được ở những phổi vốn đã đồng nhất ở cuối thì thở ra (Mascheroni và cộng sự 1988, Yoshida và cộng sự 2013).
Do đó, tính không đồng nhất của thông khí cuối thì thở ra có thể là một dấu hiệu của sự không đồng nhất về thông khí cụ thể hơn (tức là sự mở rộng không đồng đều của các đơn vị phế nang trong thì hít vào). Thật vậy, công trình ban đầu của Mead và các đồng nghiệp (Mead và cộng sự 1970) đã chỉ ra rằng khi có lực căng (thay đổi áp lực xuyên phổi), ứng suất cục bộ lên thành phế nang được nhân với phương trình sau:
APl = (V/V0)2/3 (Phương trình 14)
Ở đây, APl biểu thị sự thay đổi áp lực xuyên phổi, V là độ giãn nở thể tích của các vùng xung quanh và V0 là độ giãn nở thể tích của vùng mục tiêu.
Một nghiên cứu khác được thực hiện với pet (Wellman và cộng sự 2014) cho thấy tình trạng viêm cục bộ ở phổi bị tổn thương tỷ lệ thuận với độ giãn nở vùng chia cho thể tích ban đầu, cho thấy rằng phế nang giãn nở nhiều hơn so với thể tích ban đầu có thể phải chịu áp lực liên quan nhiều hơn. Điều này cho thấy tính không đồng nhất của thông khí có thể là yếu tố gây ra VILI như thế nào và giải thích mối tương quan giữa thông khí và thông khí không đồng nhất với kết quả của ARDS.
Chụp CT cho phép đo chính xác tính không đồng nhất của thông khí ở cuối thì thở ra. Một nghiên cứu của Cressoni và cộng sự đã định lượng tỷ lệ giữa không khí và mô xung quanh ở cấp độ phế nang và cho thấy rằng sự phân bố rải rác hơn có tương quan với mức độ nghiêm trọng của ARDS (Cressoni và cộng sự 2014). Chụp CT cũng có thể được sử dụng để đánh giá tính không đồng nhất về thông khí, nhưng điều này sẽ yêu cầu hai lần chụp CT được thực hiện ở cuối thì thở ra và cuối thì hít vào, điều này đòi hỏi phải tiếp xúc đáng kể với bức xạ.
Sự không đồng nhất về thông khí động có thể được đánh giá tại giường bệnh ở những bệnh nhân được thông khí thể tích được kiểm soát bằng cách đánh giá những thay đổi trong ARrs, như đã đề cập trước đó. Giá trị này càng cao thì càng xảy ra hiện tượng pendelluft và phân phối lại ở cuối thì hít vào, chứng tỏ sự phân bố thể tích khí lưu thông không đồng đều.
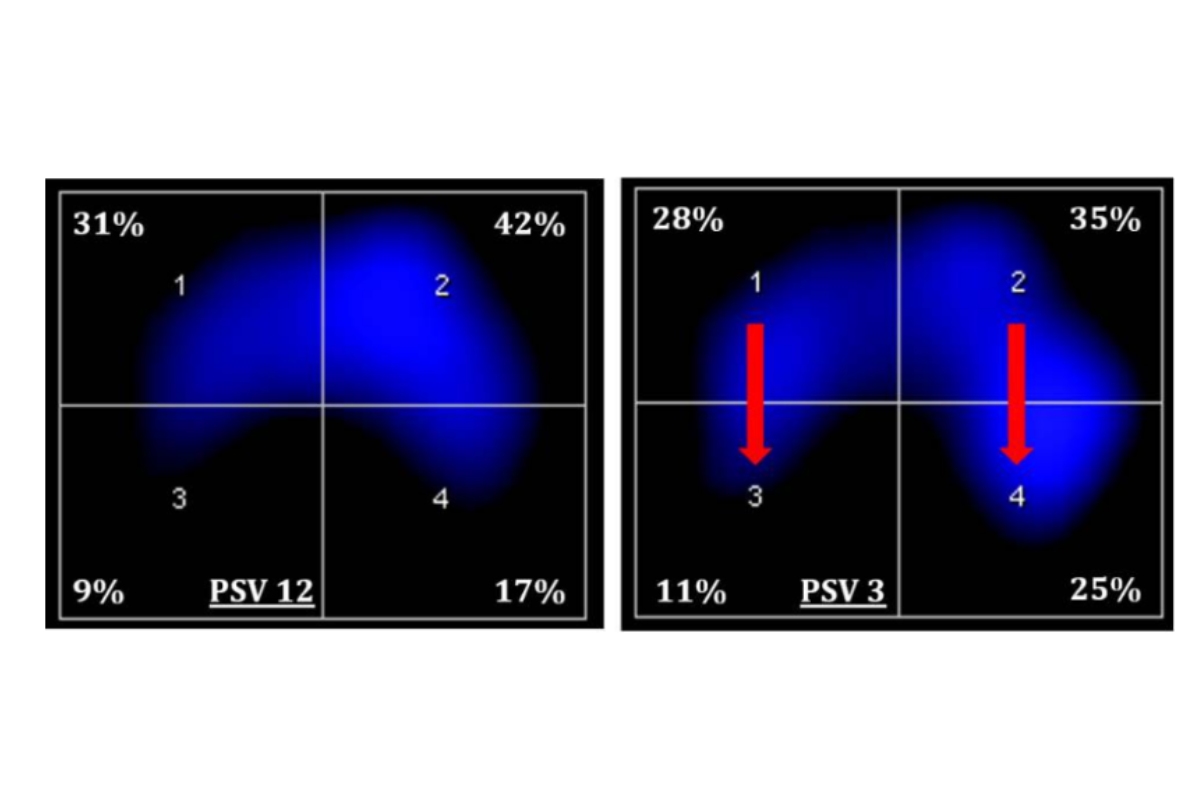
Một phương pháp tại giường không có bức xạ khác để đánh giá tính đồng nhất của thông khí là EIT (Luepschen và cộng sự 2007, Constantin và cộng sự 2014, Frerichs và cộng sự 2017), cho phép giám sát liên tục động sự phân bổ thông khí theo chu kỳ (hình 6).
Các chỉ số không đồng nhất bắt nguồn từ phạm vi EIT từ tỷ lệ đơn giản của thể tích khí lưu thông đạt đến các vùng không phụ thuộc/phụ thuộc đến các biện pháp không đồng nhất trong thủy triều động phức tạp hơn đến chỉ số không đồng nhất toàn cục ở cấp độ pixel hoặc trung tâm thông khí. Cho dù chỉ số nào được xem xét, chúng đều đề cập đến sự hiện diện của sự mất cân bằng động trong việc giãn nở phổi theo vùng, dẫn đến tăng áp lực xuyên phổi cục bộ và nguy cơ mắc VILI.
Sau khi đo được tính không đồng nhất, cài đặt thông khí nhằm giảm thiểu nó có thể được coi là sự bổ sung có giá trị cho các chiến lược thông khí bảo vệ. Cho đến nay, nhiều nghiên cứu đã chỉ ra rằng PEEP làm thay đổi tính đồng nhất (Zhao và cộng sự 2010). Điều thú vị là, nó không chỉ đơn giản là PEEP cao hơn mà còn là các cài đặt được cá nhân hóa để đạt được sự đồng nhất tốt nhất ở mỗi bệnh nhân. Trên thực tế, cả mức PEEP thấp khi phổi bị xẹp quá mức và mức PEEP cao khi phổi bị căng quá mức đều mang lại sự không đồng nhất. Bằng chứng ở động vật và gián tiếp ở người người lớn cho thấy tư thế nằm sấp cũng có thể liên quan đến tính đồng nhất cao hơn (Valenza và cộng sự 2005). Thay vào đó, trong quá trình hỗ trợ thở, hỗ trợ thấp hơn (Froese 2006, Mauri và cộng sự 2013), sự hiện diện của một số mức độ thay đổi thông khí (Bellani và cộng sự 2012, Blankman và cộng sự 2013, Mauri và cộng sự 2017) và sự mở rộng theo chu kỳ của thở sâu (Mauri và cộng sự al 2015) dường như có liên quan đến sự đồng nhất ngày càng tăng.
Tính đồng nhất là yếu tố chính quyết định mức độ nghiêm trọng của ARDS và VILI, có thể do stress cục bộ ở phổi tăng lên. Nhiều cài đặt được cá nhân hóa của các chế độ thông khí được hỗ trợ và kiểm soát có thể giúp giảm bớt tình trạng này.
Căng quá mức
Tình trạng căng quá mức thường được gọi là tình trạng phổi vùng bị căng đến mức dung tích sống cụ thể. Đối với những người khỏe mạnh, áp lực xảy ra hiện tượng này là cực kỳ cao và gần như không bao giờ đạt được (khoảng áp lực xuyên phổi là 20 cm H2O). Tuy nhiên, trong ARDS, với sự xẹp phế nang gây ra shunt trong phổi cần PEEP tăng và độ giãn nở giảm đáng kể làm tăng áp lực đẩy, các vùng phổi có thể đạt được dung tích sống ngay cả khi thông khí thể tích khí lưu thông thấp (Terragni và cộng sự 2007). Sự căng quá mức gây ra chấn thương khí áp trực tiếp làm vỡ nhu mô phổi, gây xuất huyết phế nang, hình thành bọng nước và tràn khí màng phổi. Hơn nữa, sự gia tăng gián tiếp không kiểm soát được chiều dài thành phế nang sẽ kích thích các thụ thể cụ thể và tế bào viêm, dẫn đến giải phóng các cytokine và thu hút các tế bào và gây thêm tổn thương phổi.
Vì vậy, cần tránh căng thẳng quá mức để hạn chế sự phát triển của VILI (Hong và cộng sự 2008, Kuipers và cộng sự 2012). Tình trạng căng quá mức tĩnh cuối thì thở ra thường được định lượng bằng chụp CT là lượng đơn vị phổi tăng thông khí (tức là đơn vị có giá trị đơn vị Hounsfield thấp hơn giá trị của nhu mô phổi bình thường). Các đơn vị này rõ ràng phải chịu sự giãn nở quá mức theo chu kỳ thở và các nguy cơ nêu trên, nhưng phương pháp này có thể đánh giá thấp mức độ giãn nở quá mức. Thật vậy, các vùng thường được thông khí vào cuối thì thở ra có thể bị căng quá mức ở cuối thì hít vào.
Đánh giá động về sự mở rộng liên quan đến thể tích khí lưu thông nên được mong muốn trong việc đánh giá mức độ căng quá mức. Terragni và các đồng nghiệp đã thực hiện quét CT cuối thì thở ra và cuối thì hít vào và cho thấy rằng một phần đáng kể tình trạng căng quá mức hiện diện trong phổi của bệnh nhân ARDS ngay cả trong môi trường thông khí bảo vệ, do đó gợi ý sự cần thiết phải thông khí bảo vệ cực độ bằng các phương pháp thay thế để loại bỏ CO2 (Terragni và cộng sự 2009). Tuy nhiên, việc thực hiện hai lần chụp CT có thể không khả thi trong thực hành lâm sàng hàng ngày và không thể cung cấp phương pháp theo dõi bệnh nhân theo thời gian.
Điểm uốn phía trên của đường cong P/V lưu lượng thấp cho thấy sự thay đổi đột ngột về độ giãn nở của phổi khi đạt đến mức căng quá mức và đây là cách cổ điển để đánh giá nó tại giường bệnh. Giữ Pplat ở dưới điểm uốn trên có thể là một phương pháp đơn giản và an toàn để tránh tình trạng căng quá mức. Một phương pháp khác là chỉ số căng thẳng áp lực- thời gian, xác định tình trạng căng quá mức lớn bằng sự xuất hiện của dạng lõm hướng lên trong dạng sóng đường thở trên máy thở trong quá trình thông khí lưu lượng vuông (xem ở trên). Tuy nhiên, cả đường cong P/V tổng thể và phương pháp chỉ số căng thẳng đều xác định áp lực trung bình trên mức nào phổi bị căng quá mức, trong khi một số vùng có thể đã bị kéo căng ở áp lực thấp hơn nhiều.
EIT hỗ trợ việc xác định sự căng quá mức trong khu vực bằng ít nhất hai phương pháp. Đường cong P/V ở cấp độ pixel có thể được ghi lại và hiển thị bản đồ độ lõm của nó để chọn áp lực liên quan đến hầu hết các pixel có xu hướng tuyến tính (Becher và cộng sự 2017). Hơn nữa, việc giảm giá trị khu vực của độ giãn nở tĩnh giữa hai tình trạng, chẳng hạn như hai mức PEEP, được coi là dấu hiệu căng quá mức dựa trên EIT, đặc biệt nếu điều này xảy ra ở phổi không phụ thuộc.
Liu và cộng sự đã giới thiệu một phương pháp phân loại hình ảnh EIT thành các khu vực được thông khí bình thường, được bơm phồng quá mức, được huy động và huy động/mất huy động theo chu kỳ thở để cung cấp thông tin quan trọng đầu giường (Liu và cộng sự 2016).
Trong thực hành lâm sàng hiện nay, chụp CT được coi là tiêu chuẩn vàng để xác định tình trạng phổi quá căng (tức là mật độ điểm ảnh CT dưới -850 HU), nhưng điều này thể hiện thước đo tĩnh không tương ứng với cơ chế động dẫn đến stress và vỡ phế nang, thay vào đó, được đánh giá phù hợp hơn bằng các biện pháp EIT động.
Cuối cùng, EIT tạo điều kiện thuận lợi cho việc xác định tình trạng căng quá mức trong quá trình thở tự nhiên do hít vào gắng sức gây ra sự dịch chuyển không khí và chuyển động pendelluft từ phổi không phụ thuộc sang phổi phụ thuộc (Yoshida và cộng sự 2017).
Đánh giá động về tình trạng căng quá mức vùng có thể là nhiệm vụ cơ bản để thiết lập thông khí bảo vệ và giảm áp lực xuyên phổi cục bộ. Việc giảm tình trạng căng quá mức có thể đạt được trực tiếp thông qua việc giảm thể tích khí lưu thông và PEEP, hoặc gián tiếp thông qua việc cải thiện cơ chế cục bộ và tính đồng nhất.
Kết luận
Cơ học hô hấp là một công cụ cực kỳ có giá trị tại giường bệnh để đánh giá mức độ nghiêm trọng của ARDS, phân loại bệnh nhân và hướng dẫn điều trị. Một số thông số có thể được thu thập ngay tại giường bệnh để đo stress, strain, tính không đồng nhất và căng quá mức của phổi cho toàn bộ hệ hô hấp hoặc riêng biệt cho phổi và thành ngực. Thời gian dành cho việc đo cơ học hô hấp không nên được coi là một bài tập sinh lý dành cho các chuyên gia mà là một công việc lâm sàng cập nhật của bệnh nhân ARDS.
Để lại một phản hồi