
Nội dung chính
- 1 Giới thiệu:
- 2 Loạn nhịp chậm
- 3 Sinh lý bệnh
- 4 Chẩn đoán cấp cứu
- 5 Sinh lý bệnh
- 5.1 Nhịp nhanh xoang (ST)
- 5.2 Nhịp nhanh trên thất (SVT)
- 5.3 Nhịp nhanh vòng vào lại nút xoang (SNRT)
- 5.4 Nhịp nhanh vòng vào lại nút nhĩ thất ( AVNRT)
- 5.5 Nhịp nhanh vòng vào lại nhĩ thất ( AVRT)
- 5.6 Nhịp nhanh nhĩ đơn ổ ( UAT)
- 5.7 Nhịp nhanh nhĩ đa ổ (MAT)
- 5.8 Nhịp nhanh bộ nối (JT)
- 5.9 Cuồng nhĩ với dẫn truyền cố định
- 6 Chẩn đoán cấp cứu
- 7 Đánh giá cấp cứu
- 7.1 Đánh giá ban đầu
- 7.2 Chẩn đoán
- 7.3 Điều trị
- 7.4 Bệnh nhân không ổn định
- 7.5 Bệnh nhân ổn định
- 7.6 Kiểm soát tần số
- 7.7 Kiểm soát nhịp
- 7.8 Nhịp nhanh phức bộ rộng
- 7.9 Sinh lý bệnh
- 7.10 Nhịp nhanh thất(VT)
- 7.11 Nhịp nhanh do kích thích sớm
- 7.12 Các nguyên nhân ngộ độc và chuyển hoá gây nhịp nhanh phức bộ rộng
- 7.13 Nhịp tim nhanh phức bộ rộng liên quan đến máy tạo nhịp tim
- 7.14 Đánh giá cấp cứu
- 7.15 Đánh giá ban đầu
- 7.16 Xét nghiệm chẩn đoán
- 7.17 Điều trị
Sống khỏe mỗi ngày – Chủ đề: Loạn nhịp tim
Tác giả: Neil Christopher and Wan-Tsu W. Chang
Tải bản PDF đầy đủ Tại Đây
Người dịch: BS.Nguyễn Văn Phát
Giới thiệu:
Rối loạn nhịp tim gặp trong cấp cứu và hồi sức thường là những tình huống đe dọa tính mạng, cần được chẩn đoán khẩn cấp cũng như can thiệp điều trị. Trong một số trường hợp, can thiệp có thể được yêu cầu để ổn định bệnh nhân ngay cả trước khi thiết lập một chẩn đoán chắc chắn. Do đó, một cách tiếp cận có cấu trúc đối với chứng rối loạn nhịp tim là điều cần thiết để đảm bảo rằng các chẩn đoán chính và phương thức điều trị thích hợp không bị bỏ sót. Trong chương này, chúng tôi bàn về các rối loạn nhịp tim phổ biến nhất gặp phải trong khoa cấp cứu và xử trí.
Loạn nhịp chậm
Rối loạn nhịp tim có thể là kết quả của một loạt các bệnh lý tiềm ẩn. Mặc dù các nguyên nhân tim mạch là phổ biến, đánh giá kỹ lưỡng không nên bỏ qua các nguyên nhân hô hấp (thiếu oxy), chấn thương, nội sọ và trong ổ bụng. Tình trạng không ổn định huyết động là rất hiếm, nhưng bác sĩ lâm sàng phải chuẩn bị sẵn sàng các biện pháp can thiệp khẩn cấp khi cần thiết để ổn định bệnh nhân. Chúng bao gồm thuốc cũng như các thủ thuật như tạo nhịp qua da và tĩnh mạch.
Sinh lý bệnh
Căn nguyên của rối loạn nhịp tim rất đa dạng và bao gồm thiếu máu cục bộ, nhồi máu, hạ thân nhiệt, nguyên nhân qua trung gian độc tố, bất thường điện giải, thoái hóa do tuổi tác và nhiều nguyên nhân khác. Bệnh nhân có thể xuất hiện với một loạt các triệu chứng từ mệt mỏi đến thay đổi trạng thái tri giác và ngất. Rối loạn nhịp tim có thể được phân loại thành rối loạn chức năng nút xoang và blốc nhĩ thất (Bảng 9.1). Rối loạn chức năng nút xoang là do không tạo được điện thế tim thích hợp từ nút xoang. Blốc nhĩ thất xảy ra khi dẫn truyền từ tâm nhĩ đến nút nhĩ thất và vào bó His bị gián đoạn.
Chẩn đoán cấp cứu
Đánh giá ban đầu
Bệnh nhân có rối loạn nhịp tim đáng kể phải được xác định ngay tại khoa cấp cứu. Đánh giá nhanh về đường thở, nhịp thở và tuần hoàn có thể giúp xác định sự ổn định ban đầu. Ngoài ra, đánh giá tính chất và mức độ đều đặn của mạch có thể giúp xác định rối loạn nhịp tim ngay cả trước khi lấy điện tâm đồ. Cuối cùng, các dấu hiệu sinh tồn ban đầu là một phần thiết yếu để đánh giá sự ổn định huyết động.
Tập trung bệnh sử và khám có thể giúp xác định căn nguyên của rối loạn nhịp tim. Tiền sử sử dụng máy khử rung tim hoặc máy tạo nhịp tim cấy ghép có thể gợi ý chứng rối loạn nhịp tim không ổn định tiềm ẩn. Đau bụng dữ dội khi khám có thể gợi ý một sự tổn thương trong ổ bụng gây ra nhịp tim chậm phản xạ.
| Nhịp tim chậm xoang
|
Tốc độ <60, sóng P đều đặn với khoảng PR bình thường, trước mỗi QRS
|
| ngưng xoang
|
Khử cực nhĩ vắng mặt ≥2 giây.
|
| Hội chứng nhịp tim nhanh – chậm nhịp tim (Tachy – Brady)
|
Các đợt nhịp chậm xoang hoặc ngừng xoang xen kẽ với các đợt nhịp nhanh trên thất. Rung nhĩ là nhịp cơ bản phổ biến nhất
|
| Chronotropic không thích hợp
|
Nút xoang không thể điều chỉnh nhịp tim để đáp ứng với những thay đổi trong nhu cầu trao đổi chất
|
| Block AV độ I
|
Khoảng PR> 20 msec, dẫn truyền 1: 1 P: QRS
|
| Block AV cấp hai Mobitz loại I ( Wenckebach)
Block AV cấp hai Mobitz loại II
|
sự kéo dài dần của PR trước khi không dẫn QRS
|
| Khoảng thời gian PR cố định trước khi không dẫn QRS. Nhiều khả năng bị suy giảm thành khối AV cấp độ ba
|
|
| Block AV độ III (block tim hoàn toàn)
|
Không có mối liên quan giữa sự khử cực tâm nhĩ và tâm thất xảy ra với tốc độ đều đặn nhưng độc lập
|
Chẩn đoán
Điện tâm đồ và theo dõi monitor điện tim liên tục là điều cần thiết để chẩn đoán rối loạn nhịp tim. Các xét nghiệm nên hướng vào các căn nguyên có thể được đề xuất bởi tiền sử và thăm khám. Xét nghiệm điện giải, đặc biệt là kali, canxi và magiê. Nồng độ thuốc đối với digoxin là cần thiết nếu phù hợp với tiền sử dùng thuốc. Các dấu ấn sinh học tim (ví dụ, troponin, creatine kinase, CK-MB, peptide lợi tiểu natri loại B) có thể hữu ích trong chẩn đoán nhồi máu cơ tim hoặc suy tim. Kiểm tra chức năng tuyến giáp cũng như xét nghiệm Lyme và Giang mai cũng có thể được chỉ định nếu các nguyên nhân khác đã được loại trừ. Mức độ lactate cũng có thể hữu ích nếu có lo ngại về sự thay đổi trong quá trình tưới máu. Các chẩn đoán hình ảnh nên được giới hạn và dựa trên tiền sử lâm sàng. Nghi ngờ nguyên nhân nội sọ gây rối loạn nhịp chậm nên yêu cầu chụp CT đầu. Hình ảnh bụng có thể hữu ích để hỗ trợ chẩn đoán phản xạ hoặc nhịp tim chậm tương đối. Cuối cùng, chụp X-quang phổi có thể giúp chẩn đoán suy tim bằng cách cho thấy bóng mờ bóng tim to hoặc phù phổi.
Điều trị
Chiến lược điều trị cho bệnh nhân loạn nhịp tim được hướng dẫn bởi sự ổn định lâm sàng của bệnh nhân. Các dấu hiệu không ổn định bao gồm hạ huyết áp, thay đổi trạng thái tinh thần, suy tim cấp và bằng chứng của sự tưới máu kém. Những bệnh nhân không ổn định yêu cầu tạo nhịp qua da khẩn cấp, có thể được sử dụng trong khi thuốc đang được chuẩn bị
Tạo nhịp
Tiêu chuẩn chăm sóc cho bệnh nhân nhịp tim chậm không ổn định là sử dụng máy tạo nhịp tim. Phương pháp tiếp cận qua da dễ tiếp cận nhất, do đó nên là liệu pháp đầu tay. Một điều cần cân nhắc trước khi bắt đầu tạo nhịp là an thần. Tạo nhịp qua da có thể rất đau đối với bệnh nhân tỉnh táo do phóng điện xuyên qua da và cơ. Việc lựa chọn thuốc an thần trong tình huống lâm sàng này có thể khó khăn vì nhiều thuốc thường dùng cũng gây hạ huyết áp, nhưng một số lựa chọn có tác dụng tim mạch tối thiểu bao gồm ketamine (bắt đầu với 1 mg / kg IV) và etomidate (bắt đầu với 0,15 mg / kg IV).
Sau khi chuẩn bị xong, nên bắt đầu tạo nhịp độ với tần số ban đầu ít nhất cao bằng tần số nội tại của bệnh nhân. Thông thường, tần số 60–80 nhịp / phút được chọn để đánh giá hiệu quả của việc bắt. Dòng điện có thể bắt đầu ở 10–20 mA và tăng dần cho đến khi tìm thấy QRS và sóng T rõ ràng sau mỗi nhịp được tạo (bắt được điện). Nhịp của bệnh nhân cũng phải tương ứng với nhát được tạo nhịp chứng tỏ khả năng bắt cơ học. Một số biện pháp bổ trợ để hỗ trợ xác định khả năng bắt được bao gồm xem nhịp tim trên dạng sóng của SPO2 cũng như tìm kiếm sự gia tăng nồng độ CO2 trên capnometry. Sau khi bắt được, mức hiện tại phải được đặt thành 5–10 mA trên ngưỡng bắt được. Nói chung, ngưỡng yêu cầu cho tạo nhịp phải là 40–80 mA nhưng có thể thay đổi.
Sẽ có những bệnh nhân mà nhịp xuyên da không bắt được hoặc không cải thiện được tình trạng huyết động (tức là tưới máu). Ở những bệnh nhân này, sử dụng thuốc trong khi chuẩn bị tạo nhịp qua đường tĩnh mạch sẽ là bước tiếp theo. Phần thảo luận sâu hơn về quy trình nằm ngoài phạm vi của chương này, nhưng có thể được tìm thấy trong các phần khác.
Quản lý bằng thuốc
Đối với tất cả những bệnh nhân không ổn định, có thể cần hỗ trợ đường thở và hô hấp cho họ. Khi rối loạn nhịp tim là nguyên nhân gây ra sự mất ổn định tuần hoàn của bệnh nhân, thuốc điều trị đầu tiên cho bệnh nhân này là atropine, đã được chứng minh là có tác dụng cải thiện nhịp tim và các block dẫn truyền [1]. Liều khuyến cáo là 0,5 mg tiêm tĩnh mạch mỗi 3-5 phút đến tối đa là 3 mg. Tuy nhiên, điều quan trọng cần lưu ý là atropine có thể không hiệu quả ở bệnh nhân cấy ghép tim do không có thần kinh phế vị [2]. Ngoài ra, nó sẽ không có tác dụng trong trường hợp blốc nhĩ thất độ hai loại II hoặc độ ba.
Nếu atropine không hiệu quả, thuốc được lựa chọn tiếp theo nên là thuốc beta-adrenergic. Chúng bao gồm dopamine, epinephrine hoặc isoproterenol. Nhớ lại rằng liều lượng khác nhau của dopamine có thể có tác dụng khác nhau; do đó, chúng tôi khuyến nghị liều 5–10 mcg / kg / phút. Epinephrine là một lựa chọn khác với dịch truyền tốc độ 2–10 mcg / phút [3]. Isoproterenol nhắm mục tiêu cụ thể đến hoạt động beta-adrenergic, và theo kinh nghiệm của chúng tôi, rất hữu ích trong việc điều trị nhịp tim chậm sau ghép tim và ngừng xoang. Tuy nhiên, điều này chưa được nghiên cứu rộng rãi [4] và người ta phải xem xét khả năng hạ huyết áp qua trung gian của hoạt tính beta 2 khi sử dụng tác nhân này.
Rối loạn nhịp tim do ngộ độc thuốc có thể yêu cầu xử trí cụ thể phù hợp với loại thuốc uống vào. Thuốc chẹn beta và thuốc chẹn kênh canxi là những loại thuốc có nhiều khả năng gây rối loạn nhịp tim nhất và thường là những thuốc được kê đơn quá liều không chủ ý [5]. Trong trường hợp dùng quá liều thuốc chẹn beta hoặc chẹn kênh canxi, glucagon có khả năng gây tác dụng lâm sàng [6]. Digoxin là một nguyên nhân phổ biến khác của rối loạn nhịp tim thường gặp đồng thời với blốc nhĩ thất ở 35% bệnh nhân do cửa sổ điều trị hẹp [7]. Điều trị ngộ độc thuốc cụ thể nên được bắt đầu với sự hội chẩn của các trung tâm kiểm soát chất độc địa và xem xét khử độc và chăm sóc hỗ trợ bổ sung.
Đối với bệnh nhân ổn định, trọng tâm quản lý ban đầu chuyển từ điều chỉnh rối loạn nhịp tim ác tính sang chẩn đoán và điều trị nguyên nhân cơ bản. Đánh giá lại liên tục về sự ổn định lâm sàng là quan trọng ở những bệnh nhân này vì chúng có thể nhanh chóng xấu đi. Với một số căn nguyên nhất định như bất thường về điện giải hoặc ăn phải chất độc dẫn đến loạn nhịp tim, nên bắt đầu điều trị dứt điểm nhanh chóng trong ED để giảm nguy cơ mất ổn định lâm sàng. Tuy nhiên, các căn nguyên khác (ví dụ, CHF( suy tim sung huyết) , MI(nhồi máu cơ tim) , nhiễm trùng) có thể cần nhập viện và hội chẩn chuyên khoa để xử trí dứt điểm (Bảng 9.2).
| nguyên nhân | bệnh sử | chẩn đoán | quản lý |
| Thiếu máu cục bộ cơ tim- nhồi máu thành dưới, tắc nghẽn động mạch vành phải | Đau thắt ngực trước đó | ST chênh lên, chênh xuống, troponin | Aspirin, statin, GP IIb/ IIIa inhibitor, PCI, stent, tPA |
| Tăng áp lực nội sọ | Đau đầu, thay đổi tri giác, chấn thương đầu, té ngã | Phù gai thị, CT scan | Tăng thông khí, nước muối ưu trương/ manitol. Can thiệp phẫu thuật |
| Tăng kali máu | Tiền sử bệnh thận mạn giai đoạn cuối trên nền bệnh tim | ECG , sóng T cao đỉnh, sóng hình sine, điện giải | Truyền Calci, albuterol, insulin+ glucose, kết hợp với kali, lọc máu |
| Suy giáp | Không chịu được lạnh, tăng cân, mệt mỏi | TSH ,fT4 | Levothyroxine |
| Hạ thân nhiệt | Tiếp xúc lâu với lạnh | ECG sóng Obsorn | Làm ấm |
| Nhiễm trùng – Chagas, Lyme, Parovirus, coxsackie, Syphilis | Sốt, vết cắn, đi du lịch đến vùng nguy cơ | Kháng nguyên đặc hiệu | Kháng sinh |
| Phản xạ phế vị | Đau dữ dội, lo lắng, cảm xúc mạnh | không | Không |
| Ức chế beta | Tiền sử quá liều, dùng thuốc | Nhịp chậm với block nhĩ thất | glucagon 5mg TM mỗi 10phút cho tới 3 liều |
| Chẹn kênh calci | thay đổi, nhiều thuốc | Nhịp chậm với block nhĩ thất | calcium gluconate, insulin (1u/kg bolus –> 0,5u/kg/h )+ glucose |
| Digitalis | Nôn ói, buồn nôn, đổi màu tầm nhìn vàng/ xanh, hồi hộp, lú lẫn | rung nhĩ đáp ứng thất chậm, block nhĩ thất ( I, II, III) , rung nhĩ đều , nhanh thất, ST lõm đáy chén | digoxin immune fab 10-20 lọ hoặc liều dựa trên mức độ |
| Opioids | Đồng tử co nhỏ, thở chậm | Đáp ứng với naloxone | naloxone 0,4mg TM tối đa 2mg TM nếu không đáp ứng |
| Phospho hữu cơ | Tăng tiết nước bọt, nước mắt, tiểu tiện, đại tiện, tăng nhu động ruột, đồng tử co nhỏ | Không | Atropin 2mg TM mỗi 3-5 phút ( khi nhịp chậm và giãn phế quản)+ pralidoxime ( 2 PAM ) 2gTM 10-15 phút |
Loạn nhịp nhanh
Rối loạn nhịp tim có thể bắt nguồn từ nút xoang, tâm nhĩ, nút nhĩ thất hoặc cơ thất. Một cách tiếp cận với rối loạn nhịp nhanh bắt đầu bằng việc xác định xem phức bộ QRS hẹp hay rộng và nhịp là đều hay không đều (Hình 9.1).
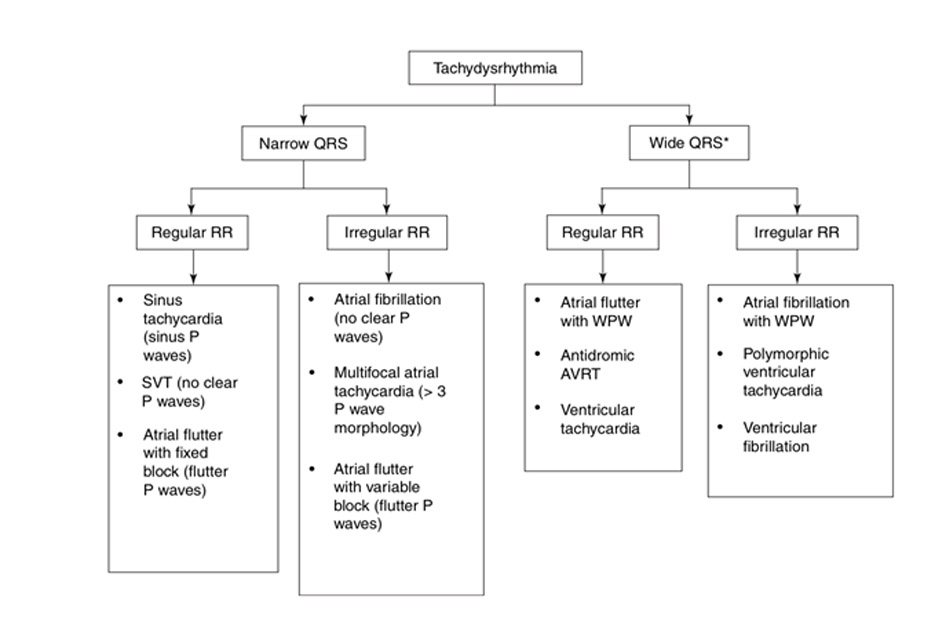
∗ Loạn nhịp nhanh QRS rộng bao gồm bất kỳ rối loạn nhịp nhanh nào kèm theo block nhánh hoặc dẫn truyền lệch hướng.
Sinh lý bệnh
Nhịp nhanh xoang (ST)
Tần số nhịp xoang lớn hơn 100 nhịp / phút xác định nhịp nhanh xoang và thường do tăng tính tự động của nút SA( nút xoang nhĩ). Hình thái sóng P giống như trong nhịp xoang với dương ở các đạo trình II, III và aVF, âm tính ở AVR, hai pha ở V1 – V2, và dương tính ở chuyển đạo V3 – V6. Nói chung, tần số tâm nhĩ dự đoán tối đa có thể được ước tính bằng công thức đơn giản là 220 – tuổi, mặc dù điều này có thể đánh giá thấp mức tối đa thực sự [8]. Nhịp tim nhanh xoang là kết quả của sự gia tăng hoạt tính adrenergic, được tìm thấy khi gắng sức, cường giáp, nhiễm trùng huyết giai đoạn cấp, suy tim mất bù, thiếu máu, sốt, thuyên tắc phổi, thiếu máu cục bộ cơ tim, giảm thể tích tuần hoàn và nhiều bệnh lý khác. Tình trạng này được gọi là nhịp nhanh xoang sinh lý, và quản lý điều trị nguyên nhân cơ bản, mặc dù gần đây đã có bằng chứng cho thấy rằng việc kiểm soát tần số trong trường hợp sốc nhiễm trùng có thể ảnh hưởng đến kết quả [9].
Nhịp tim lúc nghỉ tăng cao liên tục trong trường hợp không có yếu tố khởi phát rõ ràng được gọi là nhịp nhanh xoang không phù hợp. Nguyên nhân cơ bản là do tăng tính tự động được hoặc bất thường điều hoà tính tự động của nút xoang. Đây là một chẩn đoán loại trừ, vì tất cả các nguyên nhân khác của nhịp nhanh xoang phải được xử trí. Hội chứng nhịp tim nhanh tư thế đứng là một nhóm các dấu hiệu và triệu chứng bao gồm nhịp nhanh xoang tư thế đứng rõ rệt (tần số> 120 hoặc tăng> 30 nhịp / phút trong vòng 10 phút sau khi thay đổi tư thế) mà không có hạ huyết áp thế đứng ở bệnh nhân không mắc bệnh thần kinh tự chủ.
Nhịp nhanh trên thất (SVT)
Nhịp nhanh trên thất đề cập đến một loạt các rối loạn nhịp nhanh bắt nguồn từ nút xoang, tâm nhĩ và / hoặc nút nhĩ thất. Điều này bao gồm nhịp tim nhanh vào lại nút xoang (SNRT), nhịp nhanh vào lại nút nhĩ thất (AVNRT), nhịp nhanh vào lại nhĩ thất (AVRT), nhịp nhanh nhĩ đơn ổ (UAT), nhịp nhanh nhĩ đa ổ (MAT) và nhịp nhanh bộ nối (JT). Rung nhĩ và cuồng nhĩ có thể thoái hóa thành SVT và có thể cần một cách tiếp cận hơi khác. SVT bắt nguồn từ sự kết hợp giữa tăng tính tự độngvà sự hiện diện của các vòng vào lại để dẫn truyền. Tăng tính tự động cho phép các tế bào khử cực sớm hơn bình thường trong thời kỳ tâm trương, với kết quả là các xung động tác động lên nút xoang như trung tâm tạo nhịp tim chủ yếu. Có nhiều vùng của tim có thể biểu hiện tính tăng tự động, bao gồm các mô của tâm nhĩ, nút nhĩ thất, bó His, tĩnh mạch phổi, hoặc tĩnh mạch chủ [10, 11]. Vào lại xảy ra khi kích thích lặp đi lặp lại một vùng của tim bắt đầu từ một trọng tâm cụ thể và di chuyển qua một vòng đã xác định. Thông thường, vị trí của vào lại sẽ đặc trưng cho loại SVT với nhịp nhanh vào lại thường bắt nguồn từ nút nhĩ thất hoặc từ nhĩ thất [12].
Nhịp nhanh vòng vào lại nút xoang (SNRT)
Nhịp tim lại nút xoang là một rối loạn nhịp tim nhanh hiếm gặp, biểu hiện như nhịp tim nhanh kịch phát với sự khởi phát và chấm dứt đột ngột. Hình thái của sóng P tương tự như nhịp xoang, là kết quả của vòng vào lại nằm gần nút xoang. Một manh mối để chẩn đoán là khoảng RP dài hơn khoảng PR [13]. Nhịp điệu này thường được kích hoạt bởi một PAC( ngoại tâm thu nhĩ ). Các phản xạ phế vị rất hữu ích trong việc chấm dứt tình vòng vào lại nút xoang.
Nhịp nhanh vòng vào lại nút nhĩ thất ( AVNRT)
AVNRT là SVT phổ biến nhất và phổ biến hơn ở phụ nữ [14]. AVNRT thường không liên quan đến bệnh tim tiềm ẩn và nhịp tim điển hình nằm trong khoảng từ 100 thấp đến hơn 250 nhịp / phút [15]. Trong AVNRT, vòng vào lại ngay tại chính nút AV và bao gồm đường dẫn nhanh và đường dẫn chậm. Dẫn truyền bình thường qua đường nhanh thường dẫn đến hình thái P & QRS bình thường. Tuy nhiên, nếu tốc độ quá cao, sự dẫn truyền có thể chuyển sang con đường chậm và tạo ra một vòng lặp lại. Sau khi dẫn truyền qua nút nhĩ thất, các xung được thực hiện bởi hệ thống His – Purkinje, dẫn đến QRS hẹp (<120 ms) mà không có bất kỳ block nhánh (BBB) nào.
Nhịp nhanh vòng vào lại nhĩ thất ( AVRT)
AVRT là SVT phổ biến thứ hai với nhịp tim thường từ 120 đến 250 nhịp / phút [14–17]. Trong AVRT, nút nhĩ thất bình thường với một đường dẫn truyền duy nhất được ghép nối với một đường phụ giữa tâm nhĩ và tâm thất. Một ví dụ về kiểu dẫn truyền này xảy ra trong hội chứng Wolff – Parkinson – White (WPW) trong đó đường phụ được gọi là bó Kent.
Sự dẫn truyền bình thường trong WPW xảy ra qua cả nút nhĩ thất và bó Kent, dẫn đến khoảng PR ngắn từ dẫn truyền nhanh qua đường phụ và QRS trác đậm (sóng delta) từ quá trình khử cực tâm thất sớm qua đường phụ. Khi dẫn truyền qua nút nhĩ thất bắt kịp, phần còn lại của QRS có hình thái hẹp. AVRT thuận chiều xảy ra khi sự dẫn truyền đi xuôi dòng qua nút nhĩ thất và trở về qua đường phụ. Điều này dẫn đến một phức hợp hẹp khi không có dẫn truyền lệch hướng hoặc BBB( block nhánh) và không có sóng delta. AVRT ngược chiều xảy ra với sự dẫn truyền xuống qua đường phụ và trở về qua nút AV. Vì đường phụ khử cực cơ tim thất, rối loạn nhịp tim này là một nhịp nhanh phức bộ rộng không thể phân biệt được với VT
Ở những bệnh nhân bị rung nhĩ, các xung động có thể được dẫn truyền qua đường phụ, nút nhĩ thất, hoặc cả hai, dẫn đến nhịp tim nhanh, không đều với hình thái QRS thay đổi. AF kích thích sớm này có thể thoái hóa thành rung thất. Điều quan trọng là phải phân biệt nhịp nhanh phức hợp rộng không đều này với những loại khác, chẳng hạn như rung nhĩ với RVR( đáp ứng thất nhanh) và BBB. Một số manh mối cho thấy sự hiện diện của đường phụ bao gồm tần số thất lớn hơn 250 nhịp / phút, sự thay đổi của hình thái phức bộ QRS theo từng nhịp, và hình thái block nhánh không điển hình [18, 19].
Nhịp nhanh nhĩ đơn ổ ( UAT)
Nhịp nhanh nhĩ đơn ổ là một nhịp nhanh kịch phát phức bộ hẹp, nhịp nhanh thường xuyên được tạo ra từ một trung tâm tạo nhịp tim không nằm trong nút SA, có tốc độ từ 100 đến 250 nhịp / phút và một sóng P đơn hình. Sóng P này thường bị che khuất bởi sóng T do block AV độ một, giúp phân biệt SVT này với AVRT và AVNRT. UAT có thể được gây ra bởi tính tự động bất thường hoặc do vòng vào lại nhỏ, được phân biệt bằng sự gia tăng nhịp tim từ từ và đột ngột, tương ứng. UAT không bền thường không có triệu chứng, trong khi UAT bền vững có thể chiếm 10–15% các SVT cần cắt bỏ [20]. UAT thường thấy ở trẻ em (10–23%) và với tỷ lệ cao hơn nhiều ở những bệnh nhân mắc bệnh tim bẩm sinh, ngay cả khi đã sửa chữa [21–24]. UAT thường xảy ra ở bệnh nhân trước 40 tuổi và có liên quan đến bệnh tim mạch [17, 25].
Nhịp nhanh nhĩ đa ổ (MAT)
Nhịp nhanh nhĩ đa ổ biểu hiện là nhịp tim nhanh bất thường không đều với ba hình thái sóng P riêng biệt trở lên và tần số nhĩ lớn hơn 100 nhịp / phút. Nó gây ra 1–2% tổng số SVT, và hầu hết các trường hợp có liên quan đến bệnh phổi nặng tiềm ẩn. Nó cũng có thể xảy ra trong trường hợp viêm phổi, nhiễm trùng huyết, suy tim, nhiễm độc digoxin, và nhiễm độc theophylline và trong giai đoạn hậu phẫu [26]. Mỗi sóng P riêng biệt bắt nguồn từ một vị trí tâm nhĩ riêng biệt và dẫn đến khoảng PP, PR và RR thay đổi. Thuốc chẹn kênh canxi có thể được chỉ định để kiểm soát tốc độ, nhưng thuốc chống loạn nhịp tim hoặc thuốc sốc điện chuyển nhịp không hiệu quả. Điều chỉnh rối loạn điện giải cơ bản hoặc điều trị bệnh phổi là thành công nhất trong việc kiểm soát rối loạn nhịp tim này.
Nhịp nhanh bộ nối (JT)
Nhịp nhanh bộ nối phát sinh từ nút AV hoặc bó His chung. Nó có thể được chia thành kịch phát hoặc không kịch phát. Nhịp nhanh bộ nối kịch phát được thấy trong trẻ em bị bất thường tim bẩm sinh hoặc thanh niên trong tình trạng căng thẳng hoặc gắng sức [27]. Nhịp nhanh bộ nối không kịch phát (NPJT) là kết quả của tăng tính tự động từ các tế bào trong nút nhĩ thất hoặc bó His chung [28] hoặc như một đáp ứng với một yếu tố kích hoạt. NPJT có liên quan đến nhồi máu cơ tim cấp, hạ kali máu, bệnh phổi tắc nghẽn mãn tính với tình trạng thiếu oxy, phẫu thuật tim sau phẫu thuật, CABG, viêm cơ tim và nhiễm độc digitalis [25].
Nhịp nhanh bộ nối là một nhịp nhanh đều phức bộ hẹp. Tần số có thể cao tới 250 nhịp / phút nếu kịch phát, trong khi JT không kịch phát hiếm khi vượt quá 120 nhịp / phút. Sóng P có thể đi trước, theo sau hoặc bị chôn vùi trong phức bộ QRS. Phức bộ QRS có thể rộng nếu có BBB hoặc dẫn truyền lệch hướng. Mối quan hệ giữa tần số tâm nhĩ và tâm thất là thay đổi. Nếu blốc nhĩ thất ngược dòng sẽ có phân ly nhĩ thất và tâm nhĩ có thể ở nhịp xoang. Nếu không, sẽ có một mối quan hệ không đổi giữa QRS và sóng P với sóng P đảo ngược trong II, III và aVF. Nếu nhịp nhanh bộ nối liên quan đến rung nhĩ, cần nghi ngờ độc tính của digitalis [29].
Cuồng nhĩ với dẫn truyền cố định
Cuồng nhĩ là một rối loạn nhịp nhanh vòng vào lại lớn ở tâm nhĩ với tần số nhĩ dao động từ 250 đến 350 nhịp / phút và dẫn truyền tâm thất cố định hoặc thay đổi. Khi có blốc nhĩ thất cố định (thường là 2: 1), thường là phức bộ hẹp với tốc độ xấp xỉ 150 nhịp / phút. Tỷ lệ đặc trưng này làm nên tăng nghi ngờ đối với cuồng nhĩ với khối 2: 1 nếu nó ổn định. Điện tâm đồ thường cho thấy hình dạng răng cưa của sóng P âm trong các đạo trình II, III và aVF và không quay trở lại đường đẳng điện. Tỷ lệ thất thay đổi dựa trên sự dẫn truyền của nút nhĩ thất và nằm trong khoảng từ 1: 1 đến 4: 1. Trong dẫn truyền 1: 1, sự khử cực trong tâm thất có thể xuất hiện như một phức bộ rộng và có thể liên quan đến sự mất ổn định huyết động đáng kể. Khi dẫn truyền nhĩ thất thay đổi, điện tâm đồ sẽ cho thấy nhịp tim nhanh phức bộ hẹp không đều, có thể được phân biệt với rung nhĩ hoặc MAT bằng sự hiện diện của sóng răng cưa đồng đều ở thành dưới hoặc ở V1.
Chẩn đoán cấp cứu
Đánh giá ban đầu
Trong đánh giá ban đầu của bệnh nhân SVT, đánh giá mức độ ổn định lâm sàng là điều tối quan trọng và sẽ hướng dẫn các quyết định xử trí ban đầu. Ở những bệnh nhân ổn định, tiền sử và thăm khám tập trung có thể hỗ trợ chẩn đoán. Các triệu chứng điển hình bao gồm đánh trống ngực, khó chịu ở ngực, khó thở, mệt mỏi, choáng và ngất. Mức độ thường xuyên và đặc điểm của việc bắt đầu đánh trống ngực cũng cung cấp thông tin hữu ích, vì khởi phát đột ngột và kết thúc bằng kích thích phế vị (ví dụ: ho, Valsalva) có nhiều khả năng liên quan đến SVT trong khi khởi phát dần dần có nhiều khả năng là nhịp nhanh xoang. Ngất liên quan đến SVT có thể xảy ra khi bắt đầu và kết thúc các đợt SVT do cung lượng tim thấp hoặc tạm dừng xoang kéo dài, tương ứng. Tuy nhiên, đây không phải là điển hình và ngất do SVT có thể gợi ý một đường dẫn truyền phụ hoặc bệnh tim cấu trúc. Cuối cùng, chẩn đoán cường giáp luôn phải được xem xét ở những bệnh nhân có đợt SVT đầu tiên.
Thăm khám thường không liên quan đến chẩn đoán SVT. Tuy nhiên, đánh giá cẩn thận tình trạng thể tích có thể giúp đánh giá nhịp nhanh xoang. Hơn nữa, đánh giá các dấu hiệu của cường giáp, thiếu máu, bệnh tim tiềm ẩn (MVP, CHF) và bệnh phổi mãn tính có thể giúp xác định các việc cần thiết hơn nữa. Công việc chẩn đoán trực tiếp cho SVT có thể bao gồm sàng lọc độc chất đối với cường giao cảm hoặc kháng cholinergic, đánh giá chức năng tuyến giáp, chụp X-quang ngực để đánh giá các dấu hiệu của CHF hoặc bệnh phổi, và mức troponin tim ở những bệnh nhân có các triệu chứng phù hợp với thiếu máu cục bộ. Tuy nhiên, troponine máu tăng nhẹ có thể được coi là hậu quả của SVT và có thể dẫn đến liệu pháp chống đau thắt ngực và chụp mạch vành không phù hợp.
Chẩn đoán
Đánh giá điện tâm đồ là xét nghiệm chẩn đoán được lựa chọn và nên tập trung vào các chi tiết đã thảo luận trước đó nhưng cũng nên bao gồm đánh giá các dấu hiệu của thiếu máu cục bộ và các bất thường về dẫn truyền cơ bản (ví dụ: Brugada). Ngoài ra, một nghiên cứu cho thấy rằng sử dụng tốc độ giấy tăng lên 50 mm / giây có thể cải thiện độ chính xác chẩn đoán của các bác sĩ và ngăn chặn việc sử dụng adenosine không phù hợp [30]. Các nghiên cứu sâu hơn bao gồm siêu âm tim để đánh giá bệnh tim cấu trúc và máy theo dõi Holter hoặc thiết bị theo dõi để xác định đặc điểm của rối loạn nhịp tim thoáng qua, nhưng những phương thức này thường không được áp dụng ở cấp cứu.
Điều trị
Bệnh nhân có các triệu chứng nhẹ nhưng không ảnh hưởng đến tim mạch có thể được quản lý trên cơ sở ngoại trú để tránh các yếu tố khởi phát (tức là caffeine, rượu và ma túy bất hợp pháp) và làm việc thêm trong các phòng khám đánh giá chăm sóc ban đầu và phòng khám tim mạch. Tuy nhiên, những bệnh nhân có các triệu chứng đáng kể hoặc loạn nhịp nhanh kéo dài phải được xử trí nhanh chóng (Bảng 9.3). Đánh giá ban đầu và hỗ trợ ABC của bệnh nhân nên được theo sau bằng cách theo dõi tim phổi và đặt đường truyền tĩnh mạch. Những bệnh nhân không ổn định do rối loạn nhịp tim nhanh nên được chuẩn bị cho phương pháp sốc điện ngay lập tức. Lưu ý rằng có những bệnh nhân rung nhĩ với đáp ứng thất nhanh do sốc nhiễm trùng sẽ được hưởng lợi từ việc bù dịch tích cực hơn là tập trung vào rối loạn nhịp tim, vì vậy các quyết định xử trí rõ ràng cần phải dựa trên bối cảnh đánh giá lâm sàng. Trong khi chuẩn bị cho quá trình sốc điện, có thể cố gắng thực hiện các nghiệm pháp phế vị và / hoặc sử dụng adenosine nếu có sẵn ngay lập tức.
Chặn nút nhĩ thất
Các nghiệm pháp phế vị như xoa xoang cảnh, Valsalva, và ngâm mặt trong nước lạnh đã được chứng minh là có thể chấm dứt SVT ở 30% bệnh nhân [31]. Valsalva được chứng minh là hiệu quả nhất, chiếm 54% các trường hợp chấm dứt thành công [32]. Các nghiệm pháp này thành công nhất nếu SVT mới khởi phát khi trương lực giao cảm tăng lên trong thời gian SVT [33].
Adenosine là một chất chặn nút AV có thời gian bán hủy ngắn (<10 giây) và bắt đầu tác dụng nhanh chóng. Nó có thể được sử dụng để xác định nhịp cơ bản hoặc kết thúc các SVT nhất định (ưu tiên cho SVT vào lại). Liều ban đầu 6 mg nên được dùng khi đẩy nhanh qua một đường truyền tĩnh mạch lớn và sau đó là đẩy nhanh nước muối sinh lý, thường được thực hiện bằng khóa vòi ba chiều. Nếu không có thay đổi nào được ghi nhận, có thể tiêm liều thứ hai 12 mg. Một nghiên cứu ngẫu nhiên, mù đôi, có đối chứng với giả dược đã cho thấy chuyển đổi thành công tới 60% SVT với liều 6 mg và 90% với liều 12 mg [34, 35]. Khi dùng qua đường truyền trung tâm, nên giảm một nửa liều (3 mg và 6 mg cho liều ban đầu và liều tiếp theo)
Khi không thành công trong việc chuyển đổi sang nhịp xoang, adenosine vẫn có thể cung cấp thông tin về nhịp cơ bản, thường là biểu hiện của nhịp nhanh nhĩ với block AV cao độ hoặc sự hiện diện của một đường dẫn truyền phụ. Ngoài ra, tần số của bệnh nhân có thể dần dần chậm lại và sau đó tiếp tục rối loạn nhịp tim trước đó. Thông thường, AVRT, AVNRT và SNRT sẽ kết thúc với adenosine, trong khi ST và JT sẽ làm chậm và sau đó tiếp tục tần số trước đó của chúng. Nhịp nhanh nhĩ, rung và cuồng nhĩ sẽ tiết lộ nhịp nhĩ cơ bản của chúng với một block AV. Sử dụng Adenosine có thể liên quan đến các tác dụng phụ đáng kể, bao gồm đỏ bừng, đau ngực, nhức đầu, buồn nôn và “cảm giác sắp chết, ”tất cả đều tự giới hạn [35], nhưng cần thận trọng khi tư vấn cho bệnh nhân về những tác dụng này trước khi dùng. Một số rối loạn nhịp chậm đáng kể và rối loạn nhịp nhanh thất đã được báo cáo khi sử dụng nó [36]. Adenosine nên được sử dụng với liều lượng thấp hơn (1–3 mg) ở bệnh nhân ghép tim, vì chúng đặc biệt nhạy cảm. Theophylline và caffeine có thể làm giảm đáp ứng với adenosine, trong khi dipyridamole và carbamazepine có thể dẫn đến block tim [25]. Nếu nghi ngờ WPW, nên tránh sử dụng các chất chặn nút nhĩ nhất.
Nondihydropyridine chẹn kênh canxi làm chậm dẫn truyền và tăng tính trơ của nút nhĩ thất, có thể chấm dứt loạn nhịp tim và kiểm soát nhịp thất. Mặc dù chúng có thể làm giảm huyết áp, những tác dụng này có thể được giảm thiểu bằng cách truyền liên tục [37] và / hoặc xử lý bằng cho canxi trước [38]. Các nghiên cứu đã cho thấy sự tương đương về hiệu quả và khả năng tái phát của cả diltiazem và verapamil [37]. Diltiazem có thể được dùng với liều khởi đầu 0,25 mg / kg và liều tiếp theo là 0,35 mg / kg nếu không có đáp ứng, trong khi verapamil có thể được dùng với liều 2,5–5 mg ban đầu với các liều tiếp theo 5–10 mg. Tuy nhiên, những tác nhân này không được khuyến cáo trong bệnh nhân suy tim [25].
Ức chế beta-adrenergic có thể làm giảm nhịp tim cũng như huyết áp, với các tác dụng phụ bao gồm nhịp tim chậm và chậm dẫn truyền AV. Metoprolol có thể được truyền 5 mg trong 2 phút với liều lặp lại sau mỗi 15 phút. Có thể truyền propranolol 0,15 mg / kg trong 2 phút, và có thể truyền esmolol với liều 250–500 mcg / kg trong 1 phút, sau đó là 50 mcg / kg / phút với chỉnh liều để kiểm soát nhịp tim (liều tối đa 200 mcg / kg / phút). Những thuốc này được chống chỉ định trong block nhĩ thất độ hai và độ ba, suy tim nặng, bệnh phổi có co thắt phế quản và WPW.
Thuốc chống loạn nhịp
Procainamide, ibutilide, flecainide, propafenone và amiodarone đều có thể được sử dụng để kiểm soát nhịp ở cả SVT và rung / cuồng nhĩ với WPW. Procainamide (nhóm IA) làm chậm quá trình dẫn truyền bằng cách kéo dài thời gian trơ của mô tim và các đường dẫn truyền phụ. Thuốc được tiêm với tốc độ 20 mg / phút cho đến khi ức chế được rối loạn nhịp tim, thời gian QRS kéo dài hơn 50%, xảy ra hạ huyết áp, hoặc đạt được liều tối đa (17–20 mg / kg). Nếu thành công, có thể bắt đầu truyền liên tục 1–4 mg / phút. Amiodarone được ưu tiên dùng ở những bệnh nhân có LVEF giảm nghiêm trọng và được dùng liều 150 mg trong 10 phút, sau đó là 1 mg / phút trong 6 giờ và 0,5 mg / phút trong 18 giờ. Điều trị ban đầu có thể bao gồm bolus nhắc lại nhiều lần trước khi bắt đầu truyền nếu các tác dụng lâm sàng không hoàn tất. Hạ huyết áp và nhịp tim chậm có thể xảy ra do các tác dụng phụ được giảm thiểu bằng cách truyền chậm.
Sốc điện đồng bộ là phương pháp điều trị được khuyến cáo khi bệnh nhân không ổn định và là phương pháp điều trị ưu tiên cho bệnh nhân rung / cuồng nhĩ với WPW [19, 25, 39]. Việc cung cấp sốc điện phải được đồng bộ để ngăn ngừa hiện tượng R on T, có thể thoái hóa thành rung thất. Liều ban đầu cho sốc điện nên là 50–100 J một pha (30–50 J hai pha). Tuy nhiên, một số bác sĩ lâm sàng và các nghiên cứu báo cáo tỷ lệ thành công cao hơn bằng cách bắt đầu ở mức năng lượng cao hơn. Khi có thể, bệnh nhân nên được an thần trước khi chuyển nhịp tim. Sốc điện không có khả năng thành công đối với nhịp nhanh bộ nối hoặc MAT kết hợp.
Xem thêm: Cơn tăng đường huyết ở bệnh nhân đái tháo đường
Bảng 9.3 Những xem xét điều trị đặc hiệu cho nhịp nhanh trên thất
| Chẩn đoán | Khuyến cáo |
| Nhịp nhanh xoang | Chú ý đến nguyên nhân , ức chế beta sau MI/CHF, ngộ độc giáp và lo lắng liên quan triệu chứng |
| Nhịp nhanh vào lại nút xoang nhĩ | Cắt đốt đối với bệnh nhân có những cơ triệu chứng do nhịp nhanh không đáp ứng với thuốc chặn nút nhĩ thất |
| AVNRT | Phương pháp tiếp cận “Pill in the Pocket ”có thể được khuyến nghị cho những bệnh nhân bị AVNRT không thường xuyên, dung nạp tốt. Diltiazem + propranolol liều đơn ưu việt hơn flecainide và giả dược. Điều trị mãn tính với chặn AV hoặc digoxin; lựa chọn thứ hai là flecainide / propafenone. Cắt đốt qua ống thông được khuyến cáo nếu AVNRT có triệu chứng và bền vững. |
| AVRT | Phức bộ hẹp( thuận chiều ) : nghiệm pháp phế vị, thuốc chặn AV ( có thể thoái hoá thành rung thất nếu có WPW tồn tại ). Phức bộ rộng ( ngược chiều ) : xem như VT, xem xét procanamide / amiodarone nếu ổn định và sốc điện chuyển nhịp nếu không ổn định. Rung nhĩ/ cuồng nhĩ kịch pháp phức bộ rộng nếu ổn định có thể procainamide hoặc ibutilide , nếu không ổn định sốc điện |
| UAT | Thứ phát do vòng vào lại nhỏ nhạy với chẹn AV và sốc điện chuyển nhịp nhưng yêu cầu thuốc chống loạn nhịp Ia,Ic ,III. UAT với block AV -> ngộ độc digoxin . Cắt đốt thành công 86% và 8% chuyển sang ổ khác |
| MAT | Điều trị bệnh phổi nền, hạ oxy máu, điện giải. Ức chế beta còn đang tranh cãi nếu nguyên nhân là do bệnh phổi |
| Nhịp nhanh bộ nối | Chặn AV hiệu quả;Ia, Ic, III nếu trơ. Cắt đốt nhưng nguy cơ block AV 5-10%. Xem xé ngộ độc digoxin, hạ kali, MI, COPD, viêm cơ tim cũng như nguyên nhân khác. |
Rung nhĩ
Rung nhĩ (AF) là rối loạn nhịp nhĩ phổ biến nhất gặp ở bệnh viện, và các biểu hiện từ không triệu chứng đến đe dọa tính mạng [40-42]. Nó có liên quan đến việc gia tăng đột quỵ và các biến cố huyết khối tắc mạch và chiếm chi phí chăm sóc sức khỏe đáng kể với hơn 350.000 ca nhập viện và 276.000 lượt khám tại khoa cấp cứu [43–45]. Các yếu tố nguy cơ bao gồm bệnh van tim, rối loạn hệ thống dẫn truyền và bệnh màng ngoài tim [46]. Rung nhĩ thường liên quan đến các bất thường về điện giải, nhiễm trùng, thiếu oxy, nhiễm độc giáp, thuyên tắc phổi và nhiễm độc digoxin [47–49]. AF cũng phổ biến ở bệnh nhân sau MI với tới 15% bệnh nhân ED có AF mới khởi phát như một dấu hiệu biểu hiện của NMCT [50–53].
Sinh lý bệnh
AF bắt nguồn từ sự khử cực tâm nhĩ vô tổ chức, thường liên quan đến các vùng xơ hóa và mất cơ tim. Những khu vực này dễ xảy ra hiện tượng vòng vào lại, có thời gian trơ và điện thế hoạt động ngắn [54]. AF có thể được kích hoạt bởi nhiều cơ chế, bao gồm kích thích tăng tự động, ngoại tâm thu nhĩ, nhịp tim nhanh, đường dẫn truyền phụ, căng tâm nhĩ, hoặc các ổ bất thường trong tĩnh mạch phổi hoặc tĩnh mạch chủ [55]. Hoạt động của tâm nhĩ bị mất tổ chức làm mất lực co bóp, khi cùng với nhịp thất nhanh có thể dẫn đến tổn thương huyết động [56, 57]. AF kéo dài với tần số thất nhanh có thể dẫn đến bệnh cơ tim giãn nở, có thể gây khó khăn cho việc phục hồi và duy trì nhịp xoang [54, 58, 59].
Đánh giá cấp cứu
Đánh giá ban đầu
Việc quản lý AF bắt đầu bằng việc đánh giá mức độ ổn định dựa trên đường thở, hô hấp và tuần hoàn của bệnh nhân. Nếu có dấu hiệu không ổn định, thì chỉ định chuyển nhịp tim sớm. Tuy nhiên, ở bệnh nhân ổn định, bổ sung thông tin thêm từ bệnh sử, thăm khám và các xét nghiệm chẩn đoán có thể hữu ích trong việc xử trí. Ví dụ, các trường hợp AF thứ phát sau nhiễm trùng huyết hoặc giảm thể tích tuần hoàn có thể yêu cầu hồi sức bằng dịch hơn là chuyển nhịp tim.
Tiền sử tập trung nên đánh giá các triệu chứng lâm sàng, bao gồm lo lắng, đánh trống ngực, đau ngực, chóng mặt, khó thở hoặc yếu liệt. Ngoài các dấu hiệu sinh tồn, việc khám cần tập trung vào căn nguyên bằng cách đánh giá cường giáp, DVT hoặc thuyên tắc phổi, và các dấu hiệu của bệnh van tim hoặc suy tim.
Chẩn đoán
AF được phân biệt trên ECG với sự hiện diện của sự rung biên độ thấp thiếu sóng P rõ ràng và nhịp thất thất thường không đều với tần số thất lên đến 160 nhịp / phút. Khi kết hợp với WPW, nhịp có thể trông giống như VT, nhưng được phân biệt bởi tính không đều, hình thái QRS thay đổi và tần số trên 250 nhịp / phút.
Các xét nghiệm ban đầu nên tập trung vào các nguyên nhân trước đó và có thể bao gồm điện giải, CBC, xét nghiệm chức năng gan và đông máu. Chức năng tuyến giáp nên được đánh giá ở những bệnh nhân trên 55 tuổi, những bệnh nhân có triệu chứng lâm sàng phù hợp với cường giáp, hoặc những bệnh nhân khó kiểm soát AF [60]. Nếu có các yếu tố nguy cơ hoặc phát hiện điện tâm đồ của hội chứng mạch vành cấp, thì nên lấy các marker tim. Các xét nghiệm bổ sung bao gồm sàng lọc thuốc,nồng độ digoxin,nồng độ theophylline và thử thai nên được thực hiện khi thích hợp.
Chụp X-quang phổi có thể hỗ trợ chẩn đoán suy tim với sự hiện diện của phù phổi, bệnh van tim bằng chứng mở rộng tâm nhĩ trái hoặc thuyên tắc phổi do dấu hiệu Westermark. Siêu âm tim tập trung có thể giúp xác định sự căng dãn thất phải là dấu hiệu của thuyên tắc phổi hoặc bệnh cơ tim giãn nở có liên quan đến bệnh van tim [61–63]. Ngoài ra, siêu âm có thể giúp loại trừ các nguyên nhân khác của hạ huyết áp, bao gồm chèn ép và phình động mạch chủ bụng, cũng như đánh giá các dấu hiệu suy giảm thể tích nội mạch [64, 65]. Siêu âm qua thành ngực có thể được thực hiện như một phần của quá trình đánh giá ở bệnh nhân AF nhập viện, và có thể chỉ ra các yếu tố gây bệnh cũng như dự đoán chuyển đổi thành công sang nhịp xoang dựa trên kích thước tâm nhĩ trái [66]. Siêu âm tim qua thực quản có thể cần thiết để đánh giá huyết khối nhĩ nếu thời gian loạn nhịp không rõ [67–73].
Điều trị
Xử trí ban đầu của AF nên tập trung vào việc đảm bảo ổn định huyết động trong khi điều trị các triệu chứng và ngăn ngừa huyết khối tắc mạch [70]. Như với tất cả các rối loạn nhịp tim, sự ổn định ban đầu không loại trừ khả năng mất bù, vì vậy bác sĩ cần chuẩn bị sẵn sàng theo dõi tim mạch, lập đường truyền tĩnh mạch và cung cấp oxy.
Bệnh nhân không ổn định
Các hướng dẫn của ACLS nêu rõ rằng nên thực hiện sốc điện ở những bệnh nhân có dấu hiệu sốc hoặc huyết động không ổn định, có thể bao gồm tình trạng tri giác thay đổi, đau ngực hoặc suy tim cấp tính [74]. Ngoài ra, những bệnh nhân có QRS phức tạp rộng có thể gợi ý một đường dẫn truyền phụ nên được điều trị bằng sốc điện. Tuy nhiên, sốc điện có thể không thành công nếu AF là thứ phát của một quá trình bệnh khác (nhiễm trùng huyết, thuyên tắc phổi, chèn ép, giảm thể tích tuần hoàn) hoặc nếu bệnh đã kéo dài. Trong những trường hợp này, điều trị giảm thể tích tuần hoàn bằng hồi sức cấp tinh thể (30 ml / kg) [61] nên được bắt đầu sớm. Ngoài ra, nên xem xét các loại kháng sinh thích hợp, thuốc làm tan huyết khối, chọc dò màng tim, truyền máu và tái thông mạch máu dựa trên nguyên nhân của AF.
Sốc điện chuyển nhịp là phương pháp điều trị đầu tay của AF, có thể chuyển bệnh nhân sang nhịp xoang. Nếu được chỉ định do huyết động không ổn định, không nên từ bỏ liệu pháp này do lo ngại về thuyên tắc huyết khối. Có thể thử sốc điện đồng bộ bắt đầu với 50 J (hai pha) hoặc 100 J (một pha). Tuy nhiên, các nghiên cứu đã chỉ ra tỷ lệ thành công cao hơn với công suất cao hơn (100 J – 60% chuyển đổi, 200 J – 90%) [75]. Ngoài ra, việc áp dụng áp lực bằng tay lên miếng đệm trong quá trình tim đập có thể tăng cường dẫn điện và tăng tỷ lệ thành công [76]. Ở một bệnh nhân không ổn định và thất bại trong quá trình tim, một chiến lược thay thế là điều trị trước với liều đẩy phenylephrine (50–200 mcg Q1-2 phút) đến huyết áp tâm trương mục tiêu> 60 mmHg trước khi truyền chậm amiodarone (150 mg bolus) hoặc diltiazem. (2,5 mg / phút TTM) [77]. Ngoài ra, xử lý trước bằng canxi (5–10 ml canxi gluconat hoặc 1–3 ml canxi clorua) có thể làm giảm tác dụng hạ huyết áp của một số thuốc chẹn kênh canxi [78–81].
Bệnh nhân ổn định
Ở bệnh nhân ổn định, vấn đề quản lý chính là kiểm soát tần số so với kiểm soát nhịp. Nhiều nghiên cứu cho thấy không có sự khác biệt về tỷ lệ tử vong và tỷ lệ đột quỵ ở những bệnh nhân được điều trị bằng kiểm soát nhịp hoặc tần số [82–88]. Tuy nhiên, kiểm soát nhịp có thể có thêm lợi ích là giảm tỷ lệ nhập viện ở những bệnh nhân nguy cơ thấp có AF mới khởi phát <48 giờ [89–94]. Những lưu ý đối với thực hành này bao gồm thực tế là nhiều bệnh nhân không thể xác định được sự khởi phát của AF một cách đáng tin cậy [55, 95, 96]. Ngoài ra, vẫn chưa rõ liệu việc kiểm soát tần số trước khi chuyển nhịp có ảnh hưởng đến tỷ lệ thành công hay không [97, 98]. Ngoài ra, vì gần 50% bệnh nhân chuyển nhịp tự phát, những bệnh nhân được chọn có thể được bắt đầu kiểm soát tần số và được quản lý như một bệnh nhân ngoại trú với sự theo dõi vào ngày hôm sau.
Kiểm soát tần số
Hầu hết các thuốc kiểm soát tần số bằng cách làm chậm quá trình dẫn truyền qua nút nhĩ thất. Nên tránh những tác nhân này nếu có bất kỳ lo ngại nào về hội chứng kích thích sớm (con đường dẫn truyền phụ). Các tác nhân điển hình bao gồm thuốc chẹn beta (ví dụ, esmolol, metoprolol và propranolol) và thuốc chẹn kênh canxi nondihydro-pyridine (ví dụ, diltia-zem, verapamil). Digoxin là một chất chẹn nút AV yếu, hoạt động bằng cách tăng trương lực phế vị.
Thuốc chẹn bêta là thuốc được lựa chọn ở bệnh nhân suy tim, tăng huyết áp hoặc hội chứng mạch vành cấp tính. Propranolol đặc biệt hữu ích trong trường hợp cường giáp. Thuốc chẹn bêta nên được sử dụng thận trọng ở người suy tim mất bù cấp tính cũng như ở những bệnh nhân bị bệnh phổi tắc nghẽn.
Thuốc chẹn kênh canxi Nondihydropyridine cũng là thuốc đầu tay đặc biệt hữu ích khi có chống chỉ định chẹn beta. Verapamil có xu hướng gây giảm co và giãn mạch mạnh hơn [99]. Diltiazem khởi phát nhanh hơn cả propranolol và metoprolol [100, 101] và có hiệu quả kiểm soát tần số cao hơn digoxin hoặc amiodaron [102].
Digoxin có cả chronotropy( ảnh hưởng đến tần số) âm và inotropy( ảnh hưởng đến sức co bóp) dương, điều này đặc biệt hữu ích trong trường hợp suy tim có AF. Nó không gây hạ huyết áp đáng kể, nhưng tác dụng của nó có thể mất đến 3 giờ [103]. Do đó, digoxin đặc biệt hữu ích như một chất bổ trợ cho thuốc chẹn beta hoặc thuốc chẹn kênh canxi và có tác dụng hiệp đồng [104]. Cần lưu ý rằng mặc dù sự kết hợp của atenolol với digoxin có thể gây ra nhịp tim chậm nghiêm trọng [118], trong khi verapamil có thể làm tăng nồng độ digoxin [105].
Amiodarone là tác nhân thứ hai do khởi phát chậm hơn và tác dụng phụ đáng kể [106]. Nó ít gây “inotropy” âm tính hơn và do đó, có thể hữu ích ở những bệnh nhân bị hạ huyết áp đáng kể hoặc suy tim [107]. Nó cũng có thể thúc đẩy quá trình sốc điện, vì vậy nó nên được sử dụng thận trọng cho những bệnh nhân có nguy cơ huyết khối tắc mạch cao.
Bổ sung magiê là một liệu pháp bổ trợ, làm chậm sự dẫn truyền nút AV [108–113] mà không gây “inotropy” âm tính đáng kể hoặc các tác dụng phụ khác. Tuy nhiên, truyền nhanh có thể liên quan đến yếu cơ hô hấp, hạ huyết áp và ngừng xoang [108]. Magiê cũng có thể thúc đẩy chuyển đổi sang nhịp xoang [109].
Kiểm soát nhịp
Kiểm soát nhịp tim có thể đạt được thông qua sốc điện hoặc thuốc. Các nghiên cứu đã chỉ ra rằng thời gian lưu lại ED ngắn hơn cũng như giảm sự tái phát AF với sốc điện 89, 90]. Nếu lựa chọn phương pháp sốc điện, bệnh nhân nên được an thần trước khi làm thủ thuật. Ngoài ra, việc điều trị trước bằng thuốc chống rối loạn nhịp tim (amiodarone, flecainide, ibutilide, propafenone) có thể làm tăng thành công của quá trình sốc điện chuyển nhịp và nên được xem xét nếu nỗ lực sốc điện ban đầu không thành công.
Trước khi dùng thuốc giảm nhịp tim, nên điều chỉnh các bất thường về điện giải của bệnh nhân và kiểm tra QTc vì nhiều thuốc chống loạn nhịp có thể kéo dài QT. Procainamide (1 g trong 60 phút) là lựa chọn phổ biến nhất với tỷ lệ thành công lên đến 58% và tỷ lệ tác dụng phụ thấp. Biến chứng thường gặp nhất là hạ huyết áp tạm thời [114]. Ibutilide (1 mg trong 10 phút) là một lựa chọn khác, có tác dụng phụ bao gồm kéo dài QT và xoắn đỉnh. Amiodarone (5–7 mg / kg trong 30–60 phút sau đó là 1,2– 1,8g / ngày) là một lựa chọn thay thế khác. Các tác nhân khác bao gồm flecainide, propafenone, dofetilide và quinidine.
AF có liên quan chặt chẽ với tăng nguy cơ mắc bệnh huyết khối tắc mạch, đặc biệt là trong giai đoạn sau chuyển nhịp [115]. Lưu lượng máu bị đình trệ do co bóp kém có thể dẫn đến hình thành cục máu đông. Việc sốc điện chuyển nhịp cũng có thể dẫn đến “choáng” tâm nhĩ, trong đó sự co bóp của tâm nhĩ có thể bị suy giảm trong nhiều tuần [116]. Tỷ lệ biến cố huyết khối tắc mạch sau khi sốc điện từ 5% đến 7% nhưng giảm xuống còn <2% nếu bệnh nhân được kháng đông trong 2–4 tuần và siêu âm tim qua thực quản âm tính. Nếu chuyển nhịp tim được thực hiện trong vòng 48 giờ đầu tiên sau khi khởi phát AF, tỷ lệ thuyên tắc tương tự như ở bệnh nhân dùng kháng đông [117]. Tuy nhiên, các nghiên cứu đã báo cáo sự hiện diện của cục máu đông ở 13% bệnh nhân AF dưới 72 giờ.
Các khuyến cáo hiện tại của ACC / AHA cho thấy nếu bệnh nhân yêu cầu sốc điện ngay lập tức, họ nên bắt đầu đồng thời với heparin TTM với liều bolus và PTT mục tiêu là 1,5-2 lần bình thường. Nếu sốc điện không yêu cầu khẩn cấp, bệnh nhân nên được chống đông máu (INR 2–3) trong 3 tuần trước và 4 tuần sau khi hạ tim. Ngoài ra, siêu âm tim qua thực quản có thể loại trừ một cách đáng tin cậy huyết khối tâm nhĩ trước khi tiến hành sốc điện. Tuy nhiên, những bệnh nhân này cũng nên được đồng thời chống đông máu với heparin. Nếu không xác định được huyết khối, bệnh nhân nên được dùng kháng đông ít nhất 3 tuần trước và 4 tuần sau khi sốc điện.
Ở những bệnh nhân không điều sốc điện, nguy cơ đột quỵ nên được đánh giá để xác định nhu cầu dùng kháng đông. Nhiều nghiên cứu đã xác nhận hệ thống tính điểm CHADS2- VASc để phân loại nguy cơ đột quỵ ở bệnh nhân AF. Phương pháp này phân loại bệnh nhân thành nguy cơ thấp, trung bình và cao. Những bệnh nhân có nguy cơ cao (> 2 điểm) nên được bắt đầu điều trị bằng thuốc chống đông, trong khi những bệnh nhân có nguy cơ thấp có thể được quản lý một cách an toàn mà không cần dùng đến thuốc chống đông. Những bệnh nhân có nguy cơ trung bình cần được phân tầng nguy cơ thêm. Tuy nhiên, ngay cả trong nhóm nguy cơ cao, nguy cơ đột quỵ hàng năm dao động từ 2,2% đến 11,2%, suy ra nguy cơ hàng ngày tối đa là 0,03%. Những con số này cho thấy rằng kháng đông có thể bị trì hoãn mà không làm tăng đáng kể nguy cơ đột quỵ, điều này có thể phù hợp với những bệnh nhân có khả năng chảy máu đáng kể.
Nếu một bệnh nhân được coi là có nguy cơ thấp (<2% nguy cơ đột quỵ trên 100 bệnh nhân- năm nếu dùng aspirin), nguy cơ chảy máu khi dùng thuốc đối kháng vitamin K cao hơn đáng kể so với lợi ích giảm đột quỵ [118]. Đối với những bệnh nhân được coi là có nguy cơ cao (> 4% nguy cơ đột quỵ trên 100 bệnh nhân-năm), việc sử dụng thuốc đối kháng vitamin K đã được chứng minh là cải thiện khả năng sống sót [119]. Thuốc kháng vitamin K làm giảm nguy cơ đột quỵ đến 66%, trong khi aspirin một mình giảm nguy cơ 22% [120]. Thêm clopidogrel vào aspirin làm giảm nguy cơ đột quỵ nhưng gia tăng nguy chảy máu lớn [120]. Tuy nhiên, thuốc kháng vitamin K làm tăng 0,4% nguy cơ xuất huyết nội sọ [121]. Các tác nhân tiềm năng khác bao gồm rivaroxaban, dabigatran và apixaban, đã được chứng minh là không thua kém warfarin trong việc ngăn ngừa huyết khối tắc mạch. Tuy nhiên, các tác nhân này mang thêm rủi ro do thiếu các tác nhân đảo ngược có sẵn.
Nhịp nhanh phức bộ rộng
Nhịp tim nhanh phức bộ rộng (WCT) là rối loạn nhịp tim thường xảy ra với sự không ổn định lâm sàng đồng thời. Căn nguyên phổ biến của WCT bao gồm SVT với dẫn truyền lệch hướng, nhịp nhanh thất (VT), hội chứng kích thích sớm, cũng như WCT do ngộ độc và qua trung gian chuyển hóa. Mặc dù phương pháp điều trị an toàn và hiệu quả cho hầu hết WCT bao gồm phương pháp sốc điện, nhưng một cách tiếp cận có hệ thống để chẩn đoán WCT có thể đề xuất các biện pháp can thiệp bổ sung có khả năng ngăn ngừa các đợt tái phát.
WCT được xác định bằng tần số thất lớn hơn 100 nhịp / phút với thời gian QRS là 120 ms hoặc dài hơn ở người lớn. Rối loạn nhịp tim đáng kể này là một rối loạn thường gặp trong cấp cứu, với số lượng từ 2 đến 7 trường hợp gặp mỗi tháng [122, 123]. Sự phân tích nguyên nhân gây ra WCT có thể thay đổi, với một số nghiên cứu cho thấy 80% WCT được chẩn đoán là VT, trong khi các nghiên cứu khác cho thấy con số thực tế thấp hơn nhiều (16%) khi tính đến SVT dẫn truyền lệch hướng và rung nhĩ [124, 125].
Sinh lý bệnh
Theo các thuật ngữ cơ bản nhất, WCT xảy ra khi sự dẫn truyền xung điện qua cơ thất bị trì hoãn. Sự chậm trễ này có thể là thứ phát do hệ thống dẫn truyền bị rối loạn hoặc bị hư hỏng hoặc do thiếu sự sử dụng phần hệ thống dẫn truyền bị tổn thương.
Nhịp nhanh thất(VT)
Nhịp nhanh thất thường bắt nguồn từ một vết sẹo trong cơ tim, thường là thứ phát sau bệnh mạch vành và nhồi máu cơ tim [126, 127]. Các nghiên cứu về điện sinh lý ( EPS) ở bệnh nhân NMCT trước đó thường cho thấy có thể có nhịp nhanh thất đơn hình. Bệnh cơ tim không thiếu máu cục bộ ( thuật ngữ để chỉ bệnh giảm chức năng cơ tim do di truyền) cũng có xu hướng tạo ra sẹo có thể thúc đẩy VT.
Nhịp nhanh do kích thích sớm
Nhịp tim nhanh do kích thích sớm cũng có thể biểu hiện như một cơn nhịp nhanh phức tạp. Điều này thường xảy ra trong WPW khi xung động từ tâm nhĩ đi xuống đường phụ đến tế bào cơ tâm thất và lan truyền qua cơ tim, dẫn đến QRS rộng. Trong tình huống này, nhịp cơ bản có thể là rung nhĩ, SVT, hoặc AVRT.
Các nguyên nhân ngộ độc và chuyển hoá gây nhịp nhanh phức bộ rộng
Sự thay đổi chuyển hóa và ngộ độc cũng có thể tạo ra WCT, với các trường hợp điển hình nhất là thứ phát do quá liều TCA, tăng kali máu và độc tính chống loạn nhịp tim. Sinh lý bệnh cơ bản của những biến dạng này là sự nhiễm độc của hệ thống dẫn truyền do sự thay đổi chức năng của các kênh ion. Tác động này có thể dẫn đến cả loạn nhịp nhĩ và thất. Thông thường, rối loạn nhịp tim phát sinh từ các nguyên nhân độc hại và chuyển hóa có thể không đáp ứng với các chiến lược quản lý tiêu chuẩn. Một loại thuốc chống loạn nhịp phổ biến có thể dẫn đến loạn nhịp thất ác tính là thuốc chẹn kênh natri (Class IC – propafenone, flecainide, với flecainide liên quan đến tỷ lệ tử vong cao khi dùng quá liều [128]).
Nhiều loại thuốc khác, bao gồm thuốc chống loạn nhịp nhóm Ia và III, có thể dẫn đến loạn nhịp do kéo dài QT, dẫn đến xoắn đỉnh [129]. Độc tính của TCA cũng liên quan đến WCT trở nên tồi tệ hơn với tình trạng nhiễm toan và tăng thân nhiệt [130, 131]. Điều này thường được biểu hiện bằng phát hiện hội chứng kháng cholinergic và điện tâm đồ về sóng S sâu trong đạo trình I và R cuối trong aVR [132]. Tăng kali máu là một nguồn phổ biến khác của các bất thường dẫn truyền. Kali ngoại bào tăng cao gây ra khử cực màng dai dẳng, làm chậm quá trình dẫn truyền và hiếm khi dẫn đến QRS rộng với tần số lớn hơn 140. Sự chậm dẫn truyền được chứng minh trên ECG do không có bất kỳ sự lệch hướng nhanh nào trong phức bộ QRS [133–136].
Nhịp tim nhanh phức bộ rộng liên quan đến máy tạo nhịp tim
Trong một số trường hợp hiếm, máy tạo nhịp tim bị trục trặc có thể dẫn đến VT. Máy tạo nhịp tim đang chạy này có thể gây ra rung thất và cần được xử lý khẩn cấp. Trong hầu hết các máy tạo nhịp tim hiện đại, việc đặt nam châm trên thiết bị sẽ mặc định thiết bị ở chế độ không đồng bộ. Nếu điều này không chấm dứt nhịp, các biện pháp quyết liệt hơn như cắt dây dẫn hoặc tháo máy tạo nhịp tim có thể là cần thiết. WCT qua trung gian máy tạo nhịp tim khác bao gồm nhịp tim nhanh qua trung gian cảm biến, trong đó cảm biến hoạt động, có nghĩa là điều chỉnh nhịp tim theo nhu cầu của bệnh nhân khi gắng sức, cảm nhận không thích hợp và làm tăng nhịp thất. Điều này cũng có thể xảy ra nếu máy tạo nhịp tim cảm nhận được nhịp tâm nhĩ và phản hồi trong quá trình SVT. Cuối cùng, nếu có đường truyền ngược dòng, các xung động từ việc kích hoạt máy tạo nhịp của tâm thất có thể truyền đến tâm nhĩ và được máy tạo nhịp cảm nhận như sự khử cực tâm nhĩ, tạo ra đáp ứng. Các WCT này thường bị giới hạn bởi tần số tối đa, được lập trình trong thiết bị [137–140].
Đánh giá cấp cứu
Một trong những nguyên tắc cơ bản của quản lý VT là nhận thức rằng các can thiệp điển hình cho VT sẽ không có tác dụng nguy hiểm nếu rối loạn nhịp thực sự là SVT, nhưng điều ngược lại là không đúng. Theo đó, nếu có bất kỳ điều gì không chắc chắn, chẩn đoán VT mặc định nên được giả định và việc điều trị nên tiến hành theo hướng này. Một quan niệm sai lầm phổ biến khác là sự ổn định huyết áp trong thiết lập WCT nghiêng về SVT [141]. Tuy nhiên, huyết động không ổn định cần phải can thiệp ngay lập tức bao gồm theo dõi và kiểm tra HA thường xuyên [142–144], hoãn hỏi bệnh sử và khám cho đến khi huyết động đạt được sự ổn định.
Đánh giá ban đầu
Một số yếu tố tiền sử cụ thể có thể làm tăng đáng kể khả năng rối loạn nhịp thất. Chúng bao gồm tiền sử MI, CHF hoặc đau thắt ngực không ổn định. Trong một phân tích đơn biến hồi cứu, những đặc điểm này có liên quan đến tỷ lệ khả năng dương tính cao (> 6) và tỷ lệ khả năng âm tính thấp (<0,5). Các yếu tố bệnh sử hữu ích bổ sung bao gồm ESRD, sự hiện diện của máy tạo nhịp tim hoặc ICD, tiền sử uống thuốc để tự tử và dùng thuốc tại nhà gây rối loạn nhịp tim (TCA, digoxin, thuốc chống loạn nhịp tim). Các yếu tố này đã được chứng minh là phân biệt VT với SVT với ý nghĩa thống kê [125] và có thể gợi ý nguyên nhân của WCT, dẫn đến các bước cụ thể trong xử trí (tức là điều trị tăng kali máu theo kinh nghiệm). Tiền sử CABG, PCI, hoặc bệnh van tim không có cùng sức nặng trong việc phân biệt VT với SVT vì những chẩn đoán này không nhất thiết liên quan đến sẹo cơ tim, là căn nguyên chính của VT. Tuổi dưới 35 cũng không nên ưu tiên SVT hơn VT vì khoảng 10% các trường hợp WCT ở nhóm tuổi này là VT.
Các phát hiện thăm khám hiếm khi hữu ích, nhưng các phát hiện cụ thể về phân ly AV bao gồm sóng “a” đại bác không đều và sự biến đổi về cường độ của tiếng tim đầu tiên (S1) [145]. Ngoài ra, sự hiện diện của catheter lọc máu, cầu nối động tĩnh mạch hoặc máy tạo nhịp tim có thể xác định nguy cơ VT của bệnh nhân.
Xét nghiệm chẩn đoán
Một xét nghiệm quan trọng nhất trong phòng thí nghiệm để quản lý WCT là điện giải, vì sự thay đổi của kali và magiê có thể gây ra loạn nhịp tim cũng như làm giảm sự thành công của sốc điện chuyển nhịp. Troponin và BNP có thể hữu ích trong việc xác định căn nguyên nhưng hiếm khi thay đổi cách xử trí ban đầu. Các xét nghiệm trong phòng thí nghiệm có thể tạo ra kết quả trong vòng vài phút (tức là khí máu có chất điện giải) hữu ích nhất vì các phép đo pH và điện giải có thể thay đổi đáng kể cách xử trí ban đầu.
Phân tích chi tiết điện tâm đồ để phân biệt WCT trên thất và thất nên được loại bỏ ở những bệnh nhân có huyết động không ổn định. Những bệnh nhân này nên được chuyển nhịp bằng sôc điện ngay lập tức. Tuy nhiên, cần lưu ý rằng WCT phát sinh từ độc tính của thuốc hoặc chuyển hoá có thể kháng với sốc điện.
Bước đầu tiên để chẩn đoán WCT là thu được điện tâm đồ 12 đạo trình. Điều này sẽ giúp phân biệt sự nhiễu và WCT liên quan đến máy điều hòa nhịp tim (tiết lộ bởi các nhát do máy tạo nhịp ) với các căn nguyên khác. Nếu có thể, điện tâm đồ trước có thể hỗ trợ đáng kể trong việc chẩn đoán WCT. Nếu nhịp QRS rộng trong nhịp xoang có hình thái hoặc trục khác biệt đáng kể so với phức bộ QRS trong WCT, thì chẩn đoán VT rất được đề xuất. Điều ngược lại có thể được đề xuất một cách thận trọng nhưng vẫn tồn tại những ngoại lệ đáng kể [146–148]. Điện tâm đồ với phức bộ hẹp ít hữu ích hơn trong chẩn đoán WCT.
Do bệnh nhân vẫn ổn định về huyết động, WCT có thể được phân loại thành nhịp không đều hoặc nhịp đều. WCT không đều thường là VT đa hình, AF với dẫn truyền lệch hướng, hoặc AF với dẫn truyền xuống qua đường dẫn truyền phụ (AF với WPW). VT đa hình được đặc trưng bởi tốc độ> 200 nhịp / phút và sự thay đổi đáng kể về biên độ QRS [149]. AF dẫn truyền lệch hướng thường có tốc độ <200 nhịp / phút với biên độ QRS tương đối ổn định. AF với kích thích trước thường có tốc độ> 200 nhịp / phút với sự thay đổi theo nhịp của hình thái và biên độ QRS. WCT thông thường có thể được chia thành VT đơn hình, SVT với dẫn truyền lệch hướng, SVT với kích thích sớm hoặc WCT liên quan đến máy tạo nhịp tim.
Có nhiều tiêu chí để phân biệt các căn nguyên khác nhau của WCT. Chúng bao gồm tiêu chí Brugada cũng như tiêu chí Griffith. Để hữu ích trên lâm sàng, các tiêu chí này phải nhạy, đơn giản và dễ nhớ. Các tiêu chí Griffith gần với các tiêu chuẩn này và cung cấp một cách để mô tả cả WCT đều và không đều. Các tiêu chí này sử dụng hình thái QRS, trục và sự hiện diện của phân ly AV để xác định VT. Sự hiện diện của phân ly AV ( nhát hỗn hợp hoặc bắt được thất) trong mọi trường hợp là tiên lượng bệnh lý cho VT, nhưng điều này hiếm khi xảy ra. Phần còn lại của tiêu chí Griffith liên quan đến hình thái và trục QRS. Sử dụng khung này, WCT đều với RBBB cổ điển không có trục tây bắc (180–270 °) gợi ý về SVT với dẫn truyền lệch hướng. Ngoài ra, một WCT đều với LBBB điển hình không có trục bên phải (90–180) hoặc tây bắc (180–270) gợi ý về SVT với dẫn truyền lệch hướng. Tất cả các WCT khác nên được coi là VT. Trong khi các tiêu chí này có thể dẫn đến chẩn đoán nhầm SVT dẫn truyền lệch hướng hoặc kích thích sớm là VT, nó dẫn đến việc quản lý ED an toàn hơn bằng cách sử dụng các loại thuốc thích hợp cho VT. Trong chẩn đoán WCT không đều, trước tiên phải loại trừ VT đa hình (tốc độ> 200 nhịp / phút với phức bộ QRS biên độ thay đổi). Nếu có LBBB hoặc RBBB điển hình, chẩn đoán gợi ý là AF dẫn truyền lệch hướng. Nếu không, tất cả các WCT không đều khác phải được gắn nhãn AF với kích thích sớm Một lần nữa, phương pháp luận này có thể phân loại nhầm AF dẫn truyền lệch hướng là AF có kích thích sớm, nhưng điều này dẫn đến một thuật toán quản lý an toàn hơn thay vì ngược lại.
Điều trị
Việc điều trị WCT chủ yếu phụ thuộc vào biểu hiện lâm sàng và mức độ ổn định huyết động của bệnh nhân (Bảng 9.4.). Như đã thảo luận trước đó, phân tích nhịp rất hữu ích để điều trị trực tiếp, nhưng nó không cần thiết cho việc quản lý y tế phù hợp và an toàn. Sự không ổn định trên lâm sàng được chứng minh bằng giảm tưới máu, thiếu máu cục bộ mạch vành, tình trạng tri giác thay đổi, phù phổi, hoặc tần số nhanh. Bất kỳ WCT nào cũng có thể nhanh chóng xấu đi thành VF và sự hiện diện của các dấu hiệu bất ổn cần phải can thiệp ngay lập tức (tức là khử rung ).
Đối với bệnh nhân không ổn định, sốc điện đồng bộ là phương pháp điều trị được lựa chọn và nên thực hiện nhiều lần nếu cần. Bệnh nhân có VT không ổn định tái phát cũng nên được tiêm thuốc chống loạn nhịp qua đường tĩnh mạch. Thuốc đầu tay là amiodarone (liều 300 mg, 150 mg, sau đó 1 mg / phút × 6 giờ và 0,5 mg / phút × 18 giờ), và lidocain là một lựa chọn khác (1–1,5 mg / kg IV với liều lặp lại 0,5– 0,75 mg / kg đến tối đa 3 mg / kg và truyền 1-4 mg / phút).
Đối với những bệnh nhân ổn định, sốc điện đồng bộ nên có sẵn nhưng có thể tiến hành các nỗ lực quản lý bằng thuốc. Procainamide là thuốc được lựa chọn để chấm dứt VT ổn định (tỷ lệ chấm dứt 77%) so với amiodarone (30%) và lidocain (27%) [150– 153]. Ngoài ra, procainamide chặn các đường dẫn phụ có thể chấm dứt nhịp tim nhanh do kích thích sớm. Có thể dùng procainamide cho đến khi hết loạn nhịp hoặc một trong các trường hợp sau: hạ huyết áp, kéo dài QRS> 50% so với ban đầu, nhịp tim nhanh nặng hơn, hoặc tổng cộng 17 mg / kg được truyền. Tải nhanh có thể đạt được với tốc độ từ 100 mg / phút đến liều tối đa 10 mg / kg [151]. Liều duy trì là 1-4 mg / phút với liều thấp hơn cho người suy thận.
Amiodarone và lidocaine cũng là những lựa chọn khả thi để điều trị VT ổn định hoặc nhịp tim nhanh do kích thích sớm. Amiodarone được dùng liều bolus 150 mg trong 10 phút, duy trì 1 mg / phút trong 6 giờ và 0,5 mg / phút trong 18 giờ. Liều bolus bổ sung có thể được đưa ra khi cần thiết. Lidocaine kém hiệu quả hơn amiodarone và procainamide [153–155] đối với cả VT và nhịp nhanh kích thích sớm. Đối với VT ổn định, liều là 0,5–1,5 mg / kg trong 2 phút với liều lặp lại 0,5–0,75 mg / kg cứ sau 5–10 phút và truyền 1–4 mg / phút (liều tối đa 3 mg / kg) [ 150, 156, 157].
Nếu có một gợi ý mạnh mẽ dựa trên tiêu chí Griffith rằng WCT thực sự là SVT dẫn truyền lệch hướng (AVC) (nếu đều) hoặc AF với AVC (nếu không đều), thì thuật toán điều trị có thể tiến hành theo một con đường hơi khác cho bệnh nhân ổn định. Lưu ý rằng nếu có bất kỳ nghi ngờ nào đối với chẩn đoán, con đường điều trị mặc định nên là VT / kích thích sớm vì hậu quả của việc sử dụng chẹn nút AV trong hoàn cảnh hội chứng kích thích sớm có thể dẫn đến trụy tim mạch.
Ở những bệnh nhân SVT có kèm AVC, thuốc chặn nút AV là thuốc được lựa chọn sau khi cố gắng điều trị phế vị. Adenosine là đầu tay, với liều khởi đầu là 6 mg tiêm tĩnh mạch nhanh qua một đường truyền TM lớn tiếp theo là 12 mg nếu không thành công. Thông thường, điều này sẽ dẫn đến chuyển đổi sang nhịp xoang hoặc làm chậm phản ứng của tâm thất. Các tác nhân thay thế là thuốc chẹn beta và thuốc chẹn kênh canxi. Diltiazem có thể được dùng dưới dạng nhiều liều bolus (0,25 mg – 0,35 mg / kg mỗi liều) sau đó là liều duy trì (5–15 mg / giờ) hoặc liều nạp bằng đường uống nếu thành công. Metoprolol có thể được dùng dưới dạng liều 5 mg IV 5 phút một lần cho đến 3 liều. Ngoài ra, có thể bắt đầu dùng liều nạp 0,5 mg / kg trong 1 phút, sau đó truyền 0,05 mg / kg / phút trong 4 phút. Điều này có thể được lặp lại với việc tăng lên 0,1 mg / kg / phút nếu không thành công. Các tác dụng phụ đáng kể đối với những thuốc này bao gồm nhịp tim chậm, hạ huyết áp và phù phổi.
VT đa hình là một WCT khác được đặc trưng bởi tần số cao (> 200 nhịp / phút) và biến thiên biên độ QRS đáng kể. Nhịp này có thể nhanh chóng thoái hóa thành VF. VT đa hình kéo dài thường là nhịp không ổn định, nhưng một số bệnh nhân có thể biểu hiện các đợt tái phát tự giới hạn. Nếu không ổn định, phương pháp điều trị được lựa chọn là sốc điện. Nếu không, bước đầu tiên để xử trí là xác định khoảng QT vì VT đa hình với QT kéo dài là xoắn đỉnh, trong khi khoảng QT bình thường gợi ý thiếu máu cục bộ cơ tim. Trong trường hợp nghi ngờ thiếu máu cục bộ cơ tim, điều trị được lựa chọn là chẹn beta, dùng amiodaron và thông tim sớm.
Ức chế beta có thể bằng propranolol (0,15 mg / kg trong 10 phút và 3–5 mg mỗi 6 giờ), esmolol (300–500 mg / kg trong 1 phút và 25–50 mg / kg / phút duy trì), hoặc metoprolol (5 mg IV mỗi 5 phút tới 3 liều với liều uống 50 mg cứ 6 giờ một lần). Amiodarone liều đặc trưng 150 mg bolus sau đó truyền. Lidocain cũng có thể được sử dụng như một chất thay thế với liều lượng đã đề cập trước đó. Nếu nghi ngờ xuất hiện xoắn đỉnh, điều chỉnh nhanh chóng các chất điện giải, đặc biệt là magie và kali, là điều cần thiết. Bệnh nhân nên được tiêm liều bolus 2 gam magie sulfat IV, có thể lặp lại nếu VT vẫn còn.
Vì nhịp nhanh với khoảng QT ngắn, các phương thức điều trị khác cũng có thể hữu ích. Tạo nhịp qua tĩnh mạch hoặc xuyên da có thể được bắt đầu, đặc biệt nếu nhịp cơ bản là nhịp chậm. Ngoài ra, isoproterenol (1–4 mcg / phút) có thể được sử dụng miễn là bệnh nhân không bị tăng huyết áp đáng kể, thiếu máu cục bộ cơ tim, hoặc tiền sử hội chứng QT dài bẩm sinh, có thể khiến bệnh nhân bị rối loạn nhịp tim ác tính. Cuối cùng, trong khi lidocain cũng có thể được sử dụng cho VT đa hình với QT kéo dài, nên tránh dùng amiodaron vì nó gây kéo dài QT.
WCT qua trung gian máy tạo nhịp tim là một nguyên nhân hiếm gặp của nhịp tim nhanh phức hợp rộng mà cách xử trí khác biệt đáng kể so với các nguyên nhân khác. Nếu nghi ngờ chẩn đoán này, nên làm điện tâm đồ trước và sau khi đặt nam châm trên máy tạo nhịp tim. Các nhát nhịp nhanh nên được nhìn thấy rõ ràng trước mỗi phức bộ QRS. Việc áp dụng một nam châm vào máy tạo nhịp tim sẽ chấm dứt hầu hết các WCT qua trung gian máy tạo nhịp tim. Những thay đổi cụ thể đối với cài đặt máy tạo nhịp tim sau đó có thể được thực hiện với sự tư vấn của bác sĩ tim mạch.
WCT qua trung gian độc tính của thuốc hoặc rối loạn chuyển hóa thường có thể kháng lại sốc điện. Những bệnh nhân này có thể có biểu hiện không ổn định về huyết động đáng kể, cần phải tăng co bóp, vận mạch và thậm chí là hỗ trợ cơ học (ECMO, bơm bóng) [158]. Ngộ độc thức phát do độc tính của thuốc chống loạn nhịp nhóm 1( propafenone, flecainide)có thể điểu trị bằng natri bicarbonate Nồng độ natri tăng lên vượt qua sự chẹn kênh và có thể chấm dứt rối loạn nhịp tim. Thông thường, lượng natri bicacbonat yêu cầu cao (dao động từ 200 đến 450 meq, 3 meq / kg) [159–161].
Natri bicarbonat cũng cần thiết để điều trị ngộ độc TCA, với liều khởi đầu 1–2 meg / kg được tiêm tĩnh mạch với sự theo dõi liên tục của điện tâm đồ. Điều trị được chuẩn độ để thu hẹp phức bộ QRS và pH mục tiêu 7,5–7,55. Lidocaine và amiodarone cũng là những lựa chọn để điều trị ngộ độc flecainide [162, 163]. Điều trị tăng kali máu liên quan đến việc sử dụng các chất ổn định màng (canxi), chuyển dịch nhất thời (natri bicar-bonat, albuterol, insulin, dextrose, magie sulfat), và các chất loại bỏ (resin liên kết polystyrene và thẩm tách máu).
Bảng 9.4 chẩn đoán phân biệt các nguyên nhân nhịp nhanh QRS rộng
| Chẩn đoán | Suy xét |
| SVT với AVC | Sự chậm trễ dẫn truyền trong thất bất thường trong hệ thống His-Purkinje trong thời gian SVT (thoáng qua hoặc tồn tại trước đó) |
| VT | Bắt nguồn từ cơ tâm thất. Đơn hình – thứ phát sau mô sẹo (bệnh tim cấu trúc, MI cũ, bệnh cơ tim không thiếu máu) – dễ xuất hiện hơn ở những bệnh nhân bị MI trước đó so với những bệnh nhân có bệnh động mạch vành. Đa hình |
| Nhịp nhanh kích thích sớm | WPW – xung động dẫn xuống đường dẫn truyền phụ phụ bên ngoài nút AV và His – Purkinje. Các loại – AVRT ngược chiều, AF với kích thích sớm, SVT với kích thích sớm |
| Ngộ độc và chuyển hoá | Ngộ độc hệ thống dẫn truyền – cần có những biện pháp can thiệp cụ thể. Quá liều chống loạn nhịp – chẹn kênh natri – dẫn đến rối loạn nhịp tim, phân ly điện cơ, vô tâm thu. Quá liều Flecainide – tỷ lệ tử vong cao (8%) – kéo dài QRS và xoắn đỉnh. Độc tính TCA – hạ huyết áp và WCT – xoang với BBB, VT, VF |
| Liên quan máy tạo nhịp | Máy tạo nhịp phát nhanh( do rối loạn thiết bị của máy ), WCT qua trung gian cảm biến, nhịp nhanh vòng lập vô tận. |
Kết luận
Rối loạn nhịp tim thường là những vấn đề nguy hiểm đến tính mạng cần phải có những biện pháp can thiệp ngay lập tức và thích hợp để trực tiếp can thiệp để ổn định bệnh nhân. Tuy nhiên, một cách tiếp cận có hệ thống có thể dẫn đến các bước chẩn đoán và điều trị chính xác cho dù đối phó với rối loạn nhịp chậm hay loạn nhịp nhanh. Trong nhiều trường hợp, điều trị rối loạn nhịp tim và ổn định nhịp tim cho bệnh nhân có thể trước khi xác định căn nguyên. Dù sao đi nữa, một cách tiếp cận hợp lý như được trình bày trong chương này sẽ dẫn đến việc quản lý rối loạn nhịp tim một cách an toàn và hiệu quả trong cơ sở cấp cứu và hồi sức.
Tài liệu tham khảo
- Brady WJ, et al. The efficacy of atropine in the treat- ment of hemodynamically unstable bradycardia and atrioventricular block: prehospital and emer- gency department considerations. Resuscitation. 1999;41(1):47–55.
- Bernheim A, et al. Atropine often results in com- plete atrioventricular block or sinus arrest after cardiac transplantation: an unpredictable and dose-independent phenomenon. Transplantation. 2004;77(8):1181–5.
3.The American Heart Association in col- laboration with the International Liaison Committee on Resuscitation. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 7.3: Management of symptom- atic bradycardia and tachycardia. Circulation. 2005;112(24_supplement):IV-67-IV-77.
- Momeni M, et al. Anaphylactic shock in a beta- blocked child: usefulness of isoproterenol. Paediatr Anaesth. 2007;17(9):897–9.
- Truitt CA, et al. Outcomes of unintentional beta- blocker or calcium channel blocker overdoses: a retrospective review of poison center data. J Med Toxicol. 2012;8(2):135–9.
- Love JN, et al. A potential role for glucagon in the treatment of drug-induced symptomatic bradycardia. Chest. 1998;114(1):323–6.
- Ma G, et al. Electrocardiographic manifestations: digitalis toxicity. J Emerg Med. 2001;20(2):145–52.
- Tanaka H, Monahan KD, Seals DR. Age-predicted maximal heart rate revisited. J Am Coll Cardiol.
2001;37(1):153–6.
- Morelli A, et al. Effect of heart rate control with
esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial. JAMA. 2013;310(16):1683–91.
- Cheung DW. Electrical activity of the pulmonary vein and its interaction with the right atrium in the guinea-pig. J Physiol. 1980;314:445–56.
- Cheung DW. Pulmonary vein as an ectopic focus in digitalis-induced arrhythmia. Nature. 1981;294(5841):582–4.
- Wellens HJ. 25 years of insights into the mechanisms of supraventricular arrhythmias. Heart Rhythm. 2004;1(5 Suppl):19C–25C.
- Gomes JA, Mehta D, Langan MN. Sinus node reentrant tachycardia. Pacing Clin Electrophysiol. 1995;18(5 Pt 1):1045–57.
- Goyal R, et al. Comparison of the ages of tachycar- dia onset in patients with atrioventricular nodal reen- trant tachycardia and accessory pathway-mediated tachycardia. Am Heart J. 1996;132(4):765–7.
- Kumar UN, Rao RK, Scheinman MM. The 12-lead electrocardiogram in supraventricular tachycardia. Cardiol Clin. 2006;24(3):427–37, ix.
- Delacretaz E. Supraventricular tachycardia. N Engl J Med. 2006;354(10):1039–51.
- Rodriguez LM, et al. Age at onset and gender of patients with different types of supraventricular tachycardias. Am J Cardiol. 1992;70(13):1213–5.
- Lau EW, et al. Electrocardiographic criteria for diag- nosis of irregular broad complex tachycardia with a high sensitivity for preexcited atrial fibrillation. Pacing Clin Electrophysiol. 2000;23(12):2040–5.
- Fengler BT, et al. Atrial fibrillation in the Wolff- Parkinson-white syndrome: ECG recognition and treatment in the ED. Am J Emerg Med. 2007;25:576–83.
- Steinbeck G, Hoffmann E. ‘True’ atrial tachycardia. Eur Heart J. 1998;19(Suppl E):E10-2, E48.
- Ko JK, et al. Supraventricular tachycardia mecha- nisms and their age distribution in pediatric patients. Am J Cardiol. 1992;69(12):1028–32.
- Gillette PC. The mechanisms of supraven- tricular tachycardia in children. Circulation. 1976;54(1):133–9.
- Wu MH, et al. Radiofrequency catheter ablation of tachycardia in children with and without congeni- tal heart disease: indications and limitations. Int J Cardiol. 2000;72(3):221–7.
- Garson A, Gillette PC. Electrophysiologic studies of supraventricular tachycardia in children. I. Clinical- electrophysiologic correlations. Am Heart J. 1981;102(2):233–50.
- Blomstrom-Lundqvist C, et al. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias–executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to develop guidelines for the manage- ment of patients with Supraventricular Arrhythmias). Circulation. 2003;108(15):1871–909.
- McCord J, Borzak S. Multifocal atrial tachycardia. Chest. 1998;113(1):203–9.
- Ruder MA, et al. Clinical and electrophysiologic characterization of automatic junctional tachycardia in adults. Circulation. 1986;73(5):930–7.
- Lee KL, et al. Effect of adenosine and verapamil in catecholamine-induced accelerated atrioventricu- lar junctional rhythm: insights into the underlying mechanism. Pacing Clin Electrophysiol. 1999;22(6 Pt 1):866–70.
- Castellanos A, Sung RJ, Myerburg RJ. His bun- dle electrocardiography in digitalis-induced “atrioventricular junctional” Wenckebach peri- ods with irregular H-H intervals. Am J Cardiol. 1979;43(3):653–6.
- Accardi AJ, Miller R, Holmes JF. Enhanced diagnosis of narrow complex tachycardias with increased electrocardiograph speed. J Emerg Med. 2002;22(2):123–6.
- Lim SH, et al. Comparison of treatment of supraven- tricular tachycardia by Valsalva maneuver and carotid sinus massage. Ann Emerg Med. 1998;31(1):30–5.
- Mehta D, et al. Relative efficacy of various physical manoeuvres in the termination of junctional tachy- cardia. Lancet. 1988;1(8596):1181–5.
- Ferguson JD, DiMarco JP. Contemporary manage- ment of paroxysmal supraventricular tachycardia. Circulation. 2003;107(8):1096–9.
- Dimarco JP, Miles W, Akhtar M. Adenosine for par- oxysmal supraventricular tachycardia: dose rang- ing and comparison with verapamil. Assessment in placebo-controlled, multicenter trials. The Adenosine for PSVT Study Group. Ann Intern Med. 1990;113(2):104–10.
- Holdgate A, Ching N, Angonese L. Variability in agreement between physicians and nurses when measuring the Glasgow Coma Scale in the emer- gency department limits its clinical usefulness. Emerg Med Australas. 2006;18(4):379–84.
- Mallet ML. Proarrhythmic effects of adenos- ine: a review of the literature. Emerg Med J. 2004;21(4):408–10.
- Lim SH, Anantharaman V, Teo WS. Slow-infusion of calcium channel blockers in the emergency manage- ment of supraventricular tachycardia. Resuscitation. 2002;52(2):167–74.
- Moser LR, Smythe MA, Tisdale JE. The use of calcium salts in the prevention and management of verapamil-induced hypotension. Ann Pharmacother. 2000;34(5):622–9.
- Tijunelis MA, Herbert ME. Myth: intravenous amio- darone is safe in patients with atrial fibrillation and Wolff-Parkinson-white syndrome in the emergency department. CJEM. 2005;7(4):262–5.
- Fuster V, et al. ACC/AHA/ESC guidelines for the Management of Patients with Atrial Fibrillation: executive summary a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for practice guidelines and policy conferences (Committee to develop guidelines for the management of patients with Atrial Fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Circulation. 2001;104(17):2118–50.
- European Heart Rhythm Association, E.A.f.C.- T.S, Camm AJ, et al. Guidelines for the manage- ment of atrial fibrillation: the Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010;31(19):2369–429.
- Naccarelli GV, et al. Increasing prevalence of atrial fibrillation and flutter in the United States. Am J Cardiol. 2009;104(11):1534–9.
- Lanzarotti CJ, Olshansky B. Thromboembolism in chronic atrial flutter: is the risk underestimated? J Am Coll Cardiol. 1997;30(6):1506–11.
- Ghali WA, et al. Atrial flutter and the risk of throm- boembolism: a systematic review and meta-analysis. Am J Med. 2005;118(2):101–7.
- Coyne KS, et al. Assessing the direct costs of treat- ing nonvalvular atrial fibrillation in the United States. Value Health. 2006;9(5):348–56.
- Kannel WB, et al. Epidemiologic features of chronic atrial fibrillation: the Framingham study. N Engl J Med. 1982;306(17):1018–22.
- Benjamin EJ, et al. Independent risk fac- tors for atrial fibrillation in a population-based cohort. The Framingham Heart Study. JAMA. 1994;271(11):840–4.
- Pollock GF. Atrial fibrillation in the ED: cardio- version, rate control, anticoagulation, and more. Emergency Medicine Practice. 2002;4(8):1–28.
- Badheka AO, et al. Influence of obesity on outcomes in atrial fibrillation: yet another obesity paradox. Am J Med. 2010;123(7):646–51.
- Friedman HZ, et al. Acute complications associ- ated with new-onset atrial fibrillation. Am J Cardiol. 1991;67(5):437–9.
- Zimetbaum PJ, et al. Incidence and predictors of myocardial infarction among patients with atrial fibrillation. J Am Coll Cardiol. 2000;36(4):1223–7.
- Laurent G, et al. Atrial fibrillation during myocardial infarction with and without ST segment elevation. Arch Mal Coeur Vaiss. 2005;98(6):608–14.
- Meshkat N, et al. Troponin utilization in patients presenting with atrial fibrillation/flutter to the emer- gency department: retrospective chart review. Int J Emerg Med. 2011;4(1):25.
- Fuster V, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation- executive summary: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for practice guide- lines (Writing Committee to revise the 2001 guide- lines for the management of patients with atrial fibrillation). Eur Heart J. 2006;27(16):1979–2030.
- Allessie MA, et al. Pathophysiology and prevention of atrial fibrillation. Circulation. 2001;103(5):769–77.
- Ruskin J, et al. Pressure-flow studies in man: effect of atrial systole on left ventricular function. J Clin Invest. 1970;49(3):472–8.
- Rahimtoola SH, et al. Left atrial transport function in myocardial infarction. Importance of its booster pump function. Am J Med. 1975;59(5):686–94.
- Grogan M, et al. Left ventricular dysfunction due to atrial fibrillation in patients initially believed to have idiopathic dilated cardiomyopathy. Am J Cardiol. 1992;69(19):1570–3.
- Iga K, et al. Reversible left ventricular dysfunction secondary to rapid atrial fibrillation. Int J Cardiol. 1993;41(1):59–64.
- Frost L, Vestergaard P, Mosekilde L. Hyperthyroidism and risk of atrial fibrillation or flutter: a population-based study. Arch Intern Med. 2004;164(15):1675–8.
- Weekes AJ, Zapata RJ, Napolitano A. Symptomatic hypotension: ED stabilization and the emerging role of sonography. EM Pract. 2007;9:1–28.
- Perera P, et al. The RUSH exam: rapid ultrasound in SHock in the evaluation of the critically ill. Emerg Med Clin North Am. 2010;28(1):29–56, vii.
- Atkinson PR, et al. Abdominal and Cardiac Evaluation with Sonography in Shock (ACES): an approach by emergency physicians for the use of ultrasound in patients with undifferentiated hypoten- sion. Emerg Med J. 2009;26(2):87–91.
- Dipti A, et al. Role of inferior vena cava diameter in assessment of volume status: a meta-analysis. Am J Emerg Med. 2012;30(8):1414–1419.e1.
- Barbier C, et al. Respiratory changes in inferior vena cava diameter are helpful in predicting fluid respon- siveness in ventilated septic patients. Intensive Care Med. 2004;30(9):1740–6.
- Brodsky MA, et al. Factors determining mainte- nance of sinus rhythm after chronic atrial fibril- lation with left atrial dilatation. Am J Cardiol. 1989;63(15):1065–8.
- Silverman DI, Manning WJ. Role of echocardiogra- phy in patients undergoing elective cardioversion of atrial fibrillation. Circulation. 1998;98(5):479–86.
- Moreyra E, Finkelhor RS, Cebul RD. Limitations of transesophageal echocardiography in the risk assess- ment of patients before nonanticoagulated cardio-version from atrial fibrillation and flutter: an analysis
of pooled trials. Am Heart J. 1995;129(1):71–5.
- Manning WJ, et al. Cardioversion from atrial fibril- lation without prolonged anticoagulation with use of transesophageal echocardiography to exclude the presence of atrial thrombi. N Engl J Med.
1993;328(11):750–5.
- Black IW, et al. Evaluation of transesophageal echo-
cardiography before cardioversion of atrial fibrilla- tion and flutter in nonanticoagulated patients. Am Heart J. 1993;126(2):375–81.
- Corrado G, et al. Atrial thrombi resolution after pro- longed anticoagulation in patients with atrial fibrilla- tion. Chest. 1999;115(1):140–3.
- Klein AL, et al. Use of transesophageal echocardiog- raphy to guide cardioversion in patients with atrial fibrillation. N Engl J Med. 2001;344(19):1411–20.
- Klein AL, et al. Cardioversion guided by transesoph- ageal echocardiography: the ACUTE Pilot Study. A randomized, controlled trial. Assessment of cardio- version using transesophageal echocardiography. Ann Intern Med. 1997;126(3):200–9.
- Neumar RW, et al. Part 8: adult advanced cardiovas- cular life support: 2010 American Heart Association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation. 2010;122(18 Suppl 3):S729–67.
- Page RL, et al. Biphasic versus monophasic shock waveform for conversion of atrial fibrilla- tion: the results of an international randomized, double-blind multicenter trial. J Am Coll Cardiol. 2002;39(12):1956–63.
- Cohen TJ, et al. Active compression cardiover- sion for refractory atrial fibrillation. Am J Cardiol. 1997;80(3):354–5.
- Weingart S. The crashing atrial fibrillation patient. In: Weingart S, editor. The EMCrit blog; 2012. http://emcrit.org/podcasts/crashing-a-fib/.
- Allen R. Preventing hypotension effect of cal- cium channel blockers. Am Fam Physician. 2003;67(5):940; author reply 940–1.
- Lipman J, et al. Intravenous calcium chloride as an antidote to verapamil-induced hypotension. Intensive Care Med. 1982;8(1):55–7.
- Midtbo K, Hals O. Can blood pressure reduction induced by slow calcium channel blockade (vera- pamil) be reversed by calcium infusion? Pharmacol Toxicol. 1987;60(5):330–2.
- Weiss AT, et al. The use of calcium with verapamil in the management of supraventricular tachyarrhyth- mias. Int J Cardiol. 1983;4(3):275–84.
- Hohnloser SH, Kuck KH, Lilienthal J. Rhythm or rate control in atrial fibrillation–Pharmacological Intervention in Atrial Fibrillation (PIAF): a ran- domised trial. Lancet. 2000;356(9244):1789–94.
- Wyse DG, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med. 2002;347(23):1825–33.
- Van Gelder IC, et al. A comparison of rate con- trol and rhythm control in patients with recur-
rent persistent atrial fibrillation. N Engl J Med.
2002;347(23):1834–40.
- Carlsson J, et al. Randomized trial of rate-control ver-
sus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol. 2003;41(10):1690–6.
- Opolski G, et al. Rate control vs rhythm control in patients with nonvalvular persistent atrial fibrilla- tion: the results of the polish how to treat chronic atrial fibrillation (HOT CAFE) study. Chest. 2004;126(2):476–86.
- Roy D, et al. Rhythm control versus rate control for atrial fibrillation and heart failure. N Engl J Med. 2008;358(25):2667–77.
- Ogawa S, et al. Optimal treatment strategy for patients with paroxysmal atrial fibrillation: J-RHYTHM Study. Circ J. 2009;73(2):242–8.
- Stiell IG, et al. Association of the Ottawa Aggressive Protocol with rapid discharge of emergency depart- ment patients with recent-onset atrial fibrillation or flutter. CJEM. 2010;12(3):181–91.
- Scheuermeyer FX, Grafstein E, Stenstrom R. Thirty- day outcomes of emergency department patients undergoing electrical cardioversion for atrial fibrilla- tion or flutter. Acad Emerg Med. 2010;17(4):408–15.
- Cristoni L, et al. Cardioversion of acute atrial fibril- lation in the short observation unit: comparison of a protocol focused on electrical cardioversion with simple antiarrhythmic treatment. Emerg Med J. 2011;28(11):932–7.
- Doyle B, Reeves M. “Wait and see” approach to the emergency department cardioversion of acute atrial fibrillation. Emerg Med Int. 2011;2011:545023.
- Stiell IG, Macle L, C.C.S.A.F.G. Committee. Canadian Cardiovascular Society atrial fibrillation guidelines 2010: management of recent-onset atrial fibrillation and flutter in the emergency department. Can J Cardiol. 2011;27(1):38–46.
- Bellone A, et al. Cardioversion of acute atrial fibril- lation in the emergency department: a prospective randomised trial. Emerg Med J. 2012;29(3):188–91.
- Abarbanell NR, et al. Prehospital management of rapid atrial fibrillation: recommendations for treat- ment protocols. Am J Emerg Med. 2001;19(1):6–9.
- Camm AJ, Camm CF, Savelieva I. Medical treatment of atrial fibrillation. J Cardiovasc Med (Hagerstown). 2012;13(2):97–107.
- Blecher GE, et al. Use of rate control medication before cardioversion of recent-onset atrial fibril- lation or flutter in the emergency department is associated with reduced success rates. CJEM. 2012;14(3):169–77.
- Scheuermeyer FX, et al. Thirty-day and 1-year out- comes of emergency department patients with atrial fibrillation and no acute underlying medical cause. Ann Emerg Med. 2012;60(6):755–765.e2.
- Phillips BG, et al. Comparison of intravenous dil- tiazem and verapamil for the acute treatment of atrial fibrillation and atrial flutter. Pharmacotherapy. 1997;17(6):1238–45.
- Demircan C, et al. Comparison of the effective- ness of intravenous diltiazem and metoprolol in the management of rapid ventricular rate in atrial fibril- lation. Emerg Med J. 2005;22(6):411–4.
- Lip GYH, Tse H-F. Management of atrial fibrilla- tion. Lancet. 2007;370(9587):604–18.
- Siu C-W, et al. Intravenous diltiazem is superior to intravenous amiodarone or digoxin for achiev- ing ventricular rate control in patients with acute uncomplicated atrial fibrillation. Crit Care Med. 2009;37(7):2174–9; quiz 2180.
- Jacob S, et al. Pharmacotherapy of atrial fibrillation: a pathophysiological perspective and review. Am J Ther. 2011;18(3):241–60.
- Cheng JWM, Rybak I. Use of digoxin for heart fail- ure and atrial fibrillation in elderly patients. Am J Geriatr Pharmacother. 2010;8(5):419–27.
- Lee G. A review of the literature on atrial fibril- lation: rate reversion or control? J Clin Nurs. 2007;16(1):77–83.
- Hou ZY, et al. Acute treatment of recent-onset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone. A randomized, digoxin- controlled study. Eur Heart J. 1995;16(4):521–8.
- Lie KI, van Gelder IC. Therapy of recent onset atrial fibrillation and flutter in haemodynamically compro- mised patients: chemical conversion or control of the ventricular rate? Eur Heart J. 1995;16(4):433–4.
- Brodsky MA, et al. Magnesium therapy in new-onset atrial fibrillation. Am J Cardiol. 1994;73(16):1227–9.
- Chiladakis JA, et al. Intravenous magnesium sulfate versus diltiazem in paroxysmal atrial fibrillation. Int
J Cardiol. 2001;79(2–3):287–91.
- Chu K, et al. Magnesium sulfate versus placebo for
paroxysmal atrial fibrillation: a randomized clinical
trial. Acad Emerg Med. 2009;16(4):295–300.
- Gullestad L, et al. The effect of magnesium versus verapamil on supraventricular arrhythmias. Clin
Cardiol. 1993;16(5):429–34.
- Hays JV, Gilman JK, Rubal BJ. Effect of magnesium
sulfate on ventricular rate control in atrial fibrilla-
tion. Ann Emerg Med. 1994;24(1):61–4.
- Moran JL, et al. Parenteral magnesium sulfate ver- sus amiodarone in the therapy of atrial tachyarrhyth- mias: a prospective, randomized study. Crit Care
Med. 1995;23(11):1816–24.
- Stiell IG, et al. Emergency department use of
intravenous procainamide for patients with acute atrial fibrillation or flutter. Acad Emerg Med. 2007;14(12):1158–64.
- Berger M, Schweitzer P. Timing of thromboembolic events after electrical cardioversion of atrial fibrilla- tion or flutter: a retrospective analysis. Am J Cardiol. 1998;82(12):1545–7, A8.
- Falcone RA, Morady F, Armstrong WF. Transesophageal echocardiographic evalua- tion of left atrial appendage function and spontane- ous contrast formation after chemical or electrical cardioversion of atrial fibrillation. Am J Cardiol. 1996;78(4):435–9.
- Weigner MJ, et al. Risk for clinical thromboembo- lism associated with conversion to sinus rhythm in patients with atrial fibrillation lasting less than 48 hours. Ann Intern Med. 1997;126(8):615–20.
- Gage BF, Cardinalli AB, Owens DK. Cost- effectiveness of preference-based antithrombotic therapy for patients with nonvalvular atrial fibrilla- tion. Stroke. 1998;29(6):1083–91.
- Hart RG, et al. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta- analysis. Ann Intern Med. 1999;131(7):492–501.
- Investigators A, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med. 2009;360(20):2066–78.
- Aguilar MI, Hart R, Pearce LA. Oral anticoagulants versus antiplatelet therapy for preventing stroke in patients with non-valvular atrial fibrillation and no history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2007;3:CD006186.
- Domanovits H, et al. Sustained ventricular tachy- cardia in the emergency department. Resuscitation. 1999;42(1):19–25.
- Herbert ME, et al. Failure to agree on the electrocar- diographic diagnosis of ventricular tachycardia. Ann Emerg Med. 1996;27(1):35–8.
- Akhtar M, et al. Wide QRS complex tachycardia. Reappraisal of a common clinical problem. Ann Intern Med. 1988;109(11):905–12.
- Baerman JM, et al. Differentiation of ventricular tachycardia from supraventricular tachycardia with aberration: value of the clinical history. Ann Emerg Med. 1987;16(1):40–3.
- Josephson ME. Electrophysiology of ventricular tachycardia: an historical perspective. J Cardiovasc Electrophysiol. 2003;14(10):1134–48.
- Stevenson WG. Catheter ablation of monomor- phic ventricular tachycardia. Curr Opin Cardiol. 2005;20(1):42–7.
- Koppel C, et al. Clinical course and outcome in class IC antiarrhythmic overdose. Clin Toxicol. 1990;28(4):433–44.
- Al-Khatib SM, et al. What clinicians should know about the QT interval. JAMA. 2003;289(16):2120–7. 130. Thanacoody HKR, Thomas SHL. Tricyclic antide- pressant poisoning : cardiovascular toxicity. Toxicol
Rev. 2005;24(3):205–14.
- Bradberry SM, et al. Management of the cardio-
vascular complications of tricyclic antidepressant poisoning: role of sodium bicarbonate. Toxicol Rev. 2005;24(3):195–204.
- Liebelt EL, Francis PD, Woolf AD. ECG lead aVR versus QRS interval in predicting seizures and arrhythmias in acute tricyclic antidepressant toxic- ity. Ann Emerg Med. 1995;26(2):195–201.
- Dittrich KL, Walls RM. Hyperkalemia: ECG mani- festations and clinical considerations. J Emerg Med. 1986;4(6):449–55.
- Mattu A, Brady WJ, Robinson DA. Electrocardiographic manifestations of hyper- kalemia. Am J Emerg Med. 2000;18(6):721–9.
- Fisch C. Relation of electrolyte disturbances to car- diac arrhythmias. Circulation. 1973;47(2):408–19.
- Danaberg J. Electrolyte abnormalities affecting the heart. In: Schwartz GR, editor. Principles and prac- tice of emergency medicine. Baltimore: Williams & Wilkins; 1999. p. 425–7.
- Sobel RM, et al. Pacemaker-mediated tachycar- dia: management by pacemaker interrogation/ reprogramming in the ED. Am J Emerg Med. 2002;20:336–9.
- Love CJ. Pacemaker troubleshooting and follow-up. In: KA KGE, Lau C, et al., editors. Clinical cardiac pacing, defibrillation, and resynchronization ther- apy. Philadelphia: Saunders; 2007. p. 1047–53.
- Griffin J, Smithline H, Cook J. Runaway pace- maker: a case report and review. J Emerg Med. 2000;19(2):177–81.
- Makaryus AN, Patrick C, Maccaro P. A rare case of “runaway” pacemaker in a modern CPU- controlled pacemaker. Pacing Clin Electrophysiol. 2005;28(9):993–6.
- Stewart RB, Bardy GH, Greene HL. Wide complex tachycardia: misdiagnosis and outcome after emer- gent therapy. Ann Intern Med. 1986;104(6):766–71.
- Steinman RT, et al. Wide QRS tachycardia in the conscious adult. Ventricular tachycardia is the most frequent cause. JAMA. 1989;261(7):1013–6.
- Delbridge TR, Yealy DM. Wide complex tachycar- dia. Emerg Med Clin North Am. 1996;13:902–24.
144.Wrenn K. Management strategies in wide QRS complex tachycardia. Am J Emerg Med. 1991;9(6):592–7.
- Gupta AK, Thakur RK. Wide QRS complex tachy- cardias. Med Clin North Am. 2001;85(2):245–66, ix.
Society of Cardiology Committee for practice guidelines (writing committee to develop guide- lines for management of patients with Ventricular Arrhythmias and the prevention of sudden cardiac death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation. 2006;114(10):e385–484.
- Gorgels AP, et al. Comparison of procainamide and lidocaine in terminating sustained mono- morphic ventricular tachycardia. Am J Cardiol. 1996;78(1):43–6.
- Marill KA, et al. Amiodarone is poorly effective for the acute termination of ventricular tachycardia. Ann Emerg Med. 2006;47(3):217–24.
- Ho DS, et al. Double-blind trial of lignocaine versus sotalol for acute termination of spontane- ous sustained ventricular tachycardia. Lancet. 1994;344(8914):18–23.
- Dorian P, et al. Amiodarone as compared with lido- caine for shock-resistant ventricular fibrillation. N Engl J Med. 2002;346(12):884–90.
- Somberg JC, et al. Intravenous lidocaine versus intravenous amiodarone (in a new aqueous formu- lation) for incessant ventricular tachycardia. Am J Cardiol. 2002;90(8):853–9.
- Association, A.H. AHA guidelines for cardiopul- monary resuscitation and emergency cardiovascu- lar care management of symptomatic Bradycardia and Tachycardia. Circulation. 2005;112(Suppl I):IV–67-IV-77.
- Tomlinson DR, Cherian P, Betts TR. Should intrave- nous amiodorone be utilized for haemodynamically tolerated sustained monomorphic ventricular tachy- cardia? J Am Coll Cardiol. 2007;49(9):19A. Suppl
- Dongas J, et al. Value of preexisting bundle branch A.
block in the electrocardiographic differentiation of supraventricular from ventricular origin of wide QRS tachycardia. Am J Cardiol. 1985;55(6):717–21.
- Guo H, et al. Ventricular tachycardia with QRS configuration similar to that in sinus rhythm and a myocardial origin: differential diagnosis with bundle branch reentry. Europace. 2001;3(2):115–23.
- Oreto G, et al. Wide complex tachycardia with atrioventricular dissociation and QRS morphology identical to that of sinus rhythm: a manifestation of bundle branch reentry. Heart. 1996;76(6):541–7.
- Chou TC. Electrocardiography in clinical prac- tice: adult and pediatric. 4th ed. Philadelphia: WB Saunders Company; 1996.
- Zipes DP, et al. ACC/AHA/ESC 2006 guidelines for management of patients with Ventricular Arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European
- Timperley J, et al. Flecainide overdose–support using an intra-aortic balloon pump. BMC Emerg Med. 2005;5:10.
- Goldman MJ, Mowry JB, Kirk MA. Sodium bicar- bonate to correct widened QRS in a case of fle- cainide overdose. J Emerg Med. 1997;15(2):183–6.
- Brubacher J. Bicarbonate therapy for unstable propafenone-induced wide complex tachycardia. CJEM. 2004;6(5):349–56.
- Salerno DM, et al. Reversal of flecainide- induced ventricular arrhythmia by hypertonic sodium bicarbonate in dogs. Am J Emerg Med. 1995;13(3):285–93.
- Bauman JL, et al. Flecainide-induced sustained ven- tricular tachycardia successfully treated with lido- caine. Chest. 1987;92(3):573–5.
- Siegers A, Board PN. Amiodarone used in success- ful resuscitation after near-fatal flecainide overdose. Resuscitation. 2002;53(1):105–8.
Để lại một phản hồi