Nội dung chính
- 1 Lịch sử nghiên cứu và phát triển
- 2 Tên quốc tế, tên khác, công thức cấu tạo
- 3 Nguồn gốc và các phương pháp điều chế chính
- 4 Tính chất lý hóa, ứng dụng trong kiểm nghiệm, bảo quản, dạng dược dụng
- 5 Tác dụng và cơ chế tác dụng
- 6 Cơ chế đề kháng thuốc
- 7 Dược động học
- 8 Chỉ định điều trị
- 9 Tác dụng không mong muốn
- 10 Thận trọng và cảnh báo
- 11 Chú ý khi sử dụng chung với thuốc khác
- 12 Chống chỉ định
- 13 Các dạng bào chế thường gặp
Trên thị trường hiện nay có rất nhiều thông tin về sản phẩm Stavudin tuy nhiên lại không đầy đủ. Bài này https://songkhoemoingay.com xin được giải đáp cho bạn các câu hỏi: Stavudin là thuốc gì? Thuốc Stavudin có tác dụng gì? Dưới đây là thông tin chi tiết.
Lịch sử nghiên cứu và phát triển
Stavudine lần đầu được tổng hợp bởi Jerome Horwitz vào những năm 1960, ban đầu được đặt tên là d4T. Khi đại dịch AIDS xảy ra vào những năm 1980, William Prusoff và Tiến sĩ Tai-Shun Lin đã phát hiện ra các đặc tính kháng HIV của stavudine. Công ty Dược phẩm Bristol-Myers Squibb sản xuất thuốc dưới tên thương mại Zerit.
Stavudine cũng là thuốc đầu tiên được FDA cho phép cung cấp cho bệnh nhân trước khi được chấp thuận. Stavudine đã được đệ trình theo quy trình phê duyệt tăng tốc của FDA. Thông qua quy trình này, hiệu quả của stavudine được đo lường bằng tác động của nó với dấu hiệu thay thế (T-CD4), thay vì điểm cuối lâm sàng. FDA kết luận sự gia tăng số lượng tế bào T-CD4 là một chỉ số chứng minh tính hiệu quả của thuốc này trong điều trị HIV/AIDS. Stavudine là thuốc thứ tư được FDA phê duyệt để điều trị HIV/AIDS vào ngày 27/06/1994. Kể cả sau khi được phê duyệt, các nghiên cứu vẫn tiếp tục đánh giá lợi ích lâm sàng của thuốc.
Nguồn: https://en.wikipedia.org/wiki/Stavudine
Tên quốc tế, tên khác, công thức cấu tạo
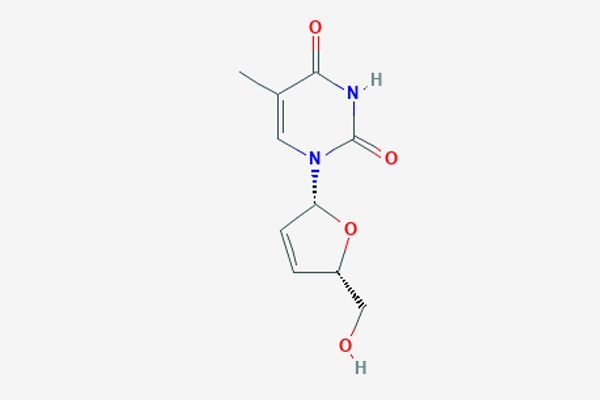
Tên quốc tế: 1-[(2R,5S)-5-(hydroxymethyl)-2,5-dihydrofuran-2-yl]-5-methyl-1,2,3,4-tetrahydropyrimidine-2,4-dione.
Tên khác: 2′,3′-didehydro-3′-deoxythymidine, d4T, Zerit (tên thương mại)…
Nguồn gốc và các phương pháp điều chế chính
Nguồn gốc: Tổng hợp hóa dược.
Quy trình điều chế:
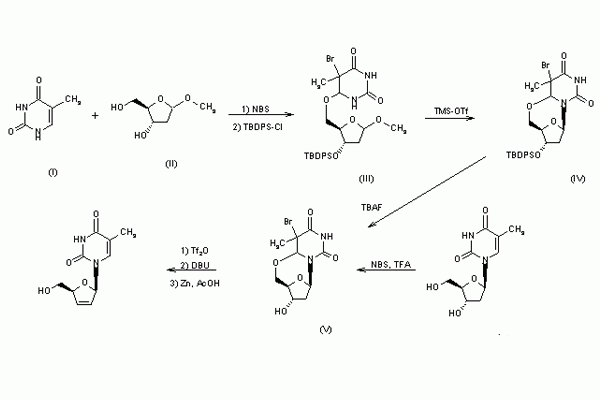
Chú ý: Quy trình trên chỉ mang tính chất tham khảo.
Tính chất lý hóa, ứng dụng trong kiểm nghiệm, bảo quản, dạng dược dụng
Lý tính
• Cảm quan: Bột kết tinh trắng hoặc gần như trắng.
• Độ tan: Tan trong nước, tan ít trong ethanol 96% và methylene choloride.
• Nhiệt độ nóng chảy xác định.
• Làm quay mặt phẳng ánh sáng phân cực do có hai Carbon bất đối.
• Hấp thụ UV.
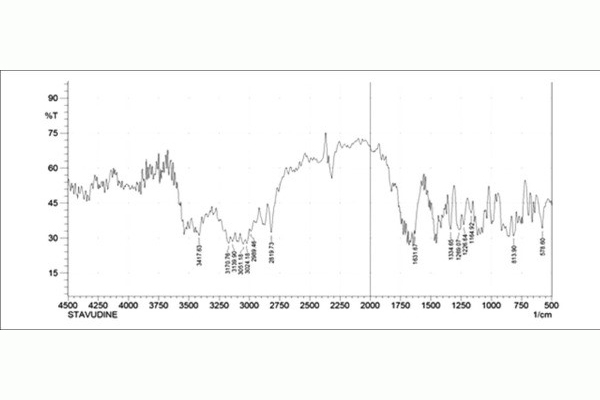
• Phổ IR đặc trưng.
Ứng dụng trong kiểm nghiệm:
Định tính:
Đo nhiệt độ nóng chảy.
Đo năng suất quay cực.
Đo phổ IR, đối chiếu với phổ stavudine chuẩn.
Sắc kí lớp mỏng (TLC), đối chiếu với stavudine chuẩn.
Sắc kí lỏng hiệu năng cao (HPLC).
Định lượng:
Đo quang phổ hấp thụ tử ngoại (Đo UV).
Sắc kí lỏng hiệu năng cao (HPLC).
– Bảo quản: Bảo quản nơi khô ráo, thoáng mát, tránh ánh sáng, nhiệt độ dưới 30○C.
– Dạng dược dụng: Viên nang, bột pha dung dịch uống.
Tác dụng và cơ chế tác dụng
Tác dụng
Stavudine là thuốc kháng retrovirus (ARV), thuộc nhóm thuốc NRTIs (Nucleotide Reserve Transcriptase Inhibitors), các thuốc thuộc nhóm này có tác dụng ức chế enzym phiên mã ngược (Reserve Transcriptase) theo cơ chế cạnh tranh với cơ chất của enzyme.
Cơ chế tác dụng
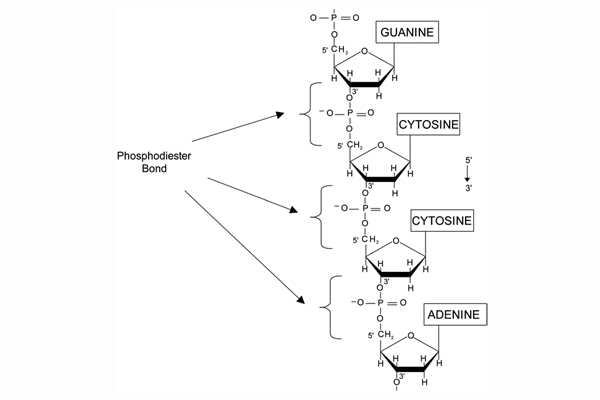
Ảnh 1 thể hiện sự liên kết giữa các nucleotide thông thường qua một liên kết được gọi là phosphodiester, hình thành giữa nhóm 3’–OH của nucleotide này với nhóm phosphate (PO43-) gắn vào 5’–OH của nucleotide kia.
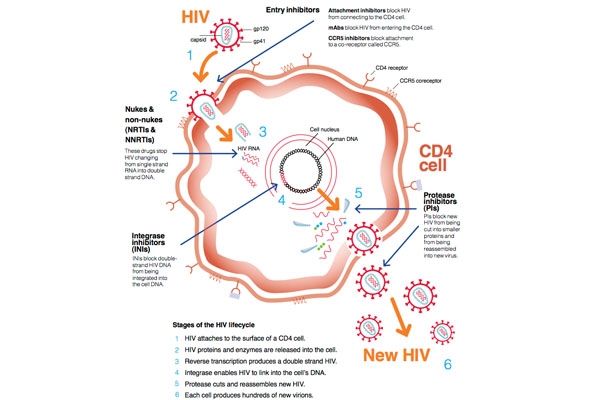
Ảnh 2 là hình ảnh thể hiện một vòng đời của virus HIV và các nhóm thuốc điều trị HIV hiện nay.
Ta quan tâm đến một enzyme có tên là enzyme phiên mã ngược. Enzyme này có tác dụng tổng hợp ra một ADN sợi đơn (cADN) từ mạch khuôn là ARN của virus. Rồi từ cADN này, ADN mạch kép được tổng hợp, đi vào nhân tế bào và tích hợp vào ADN tế bào chủ (tế bào T-CD4), sau đó tiếp tục những bước tiếp theo để hoàn thiện cấu trúc virus, thoát khỏi tế bào này và lây nhiễm đến những tế bào khác để tiếp tục một chu kì mới.
Stavudine hoạt động bằng cách ức chế enzyme phiên mã ngược theo cơ chế cạnh tranh với cơ chất của enzyme, mà cụ thể ở đây là thymidine triphosphate. Vào trong tế bào, stavudine được phosphoryl hóa thành dạng monophosphate nhờ một enzym có tên là thymidine kinase, sau đó tiếp tục được phosphoryl hóa thêm hai lần nữa để thành dạng triphosphate, sau đó nó tham gia vào quá trình tổng hợp nên cADN của virus trong tế bào chủ.
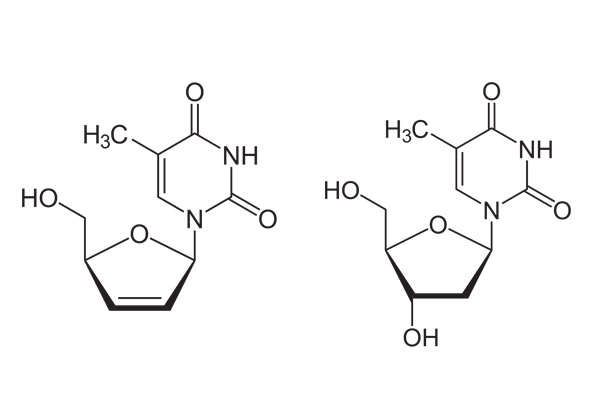
Tuy nhiên, stavudine có một điểm khác biệt nhỏ trong cấu trúc so với thymidine, đó là nó không còn nhóm 3’-OH (ảnh 3), điều đó đồng nghĩa với việc stavudine triphosphate không thể tạo liên kết phosphodiester với nucleotide tiếp theo. Như vậy quá trình phiên mã ngược bị dừng lại. Quá trình nhân lên của virus bị ức chế.
Cơ chế đề kháng thuốc
Dưới đây là cơ chế đề kháng thuốc chung của các NRTIs.
Một số virus có đột biến điểm K65R, L74V, Q151M và M184V, emzyme phiên mã ngược của nó có ái lực gắn với các NRTIs giảm, trong khi vẫn có khả năng gắn được với các chất nền deoxynucleoside triphosphate (dNTP) tự nhiên tương tự (ái lực gần như không đổi).
Một cơ chế đề kháng thuốc khác là đột biến giúp tăng cường hoạt động “bỏ chặn đoạn mồi” (primer unblocking), được chọn lọc bởi zidovudine (AZT) và stavudine (d4T), gọi là đột biến tương tự thymidine (thymidine analogue mutations, TAMs): M41L, D67N, K70R, L210W, T215Y/F19. TAMs liên quan đến việc kháng tất cả các NRTIs, ngoại trừ lamivudine (3TC), nhưng mức độ kháng chéo phụ thuộc vào NRTIs được xem xét và số lượng TAMs trên virus. Các đột biến M184V/I, được chọn lọc bởi 3TC và emtricitabine (FTC), làm chậm sự xuất hiện của TAMs và làm tăng tính nhạy cảm trong ống nghiệm đối với AZT và d4T.
Dược động học
Hấp thu: Stavudine được hấp thu nhanh sau khi uống, đạt nồng độ đỉnh trong huyết tương trong vòng 1 giờ và sinh khả dụng khoảng 86% ở người lớn và 77% ở trẻ từ 5 tuần tới 15 tuổi. Một giờ sau khi uống liều duy nhất 0,67 mg/kg, nồng độ đỉnh trong huyết tương đạt 1,2 mg/lít. Uống lúc no làm giảm nồng độ đỉnh và thời gian đạt nồng độ đỉnh của thuốc trong máu nhưng không ảnh hưởng đáng kể đến diện tích dưới đường cong của thuốc. Nồng độ đỉnh và diện tích dưới đường cong của thuốc tăng tỉ lệ thuận với liều trong khoảng 0,03 – 4 mg/kg.
Phân bố: Tỷ lệ thuốc gắn vào protein huyết tương không đáng kể. Thể tích phân bố ở trạng thái cân bằng là 46 lít ở người lớn và 0,73 lít/kg ở trẻ từ 5 tuần tới 15 tuổi. Stavudine qua hàng rào máu não, sau 4 giờ tỷ lệ nồng độ thuốc trong dịch não tủy so với huyết tương là 30 – 40%. Ít có sự dao động về dược động học của thuốc giữa các cá thể và ở từng người.
Chuyển hóa: Trong tế bào, stavudine chuyển hóa thành chất chuyển hóa triphosphate có hoạt tính.
Thải trừ: Nửa đời thải trừ sau khi uống liều đơn hoặc uống nhiều liều khoảng 1 – 1,5 giờ. In vitro, nửa đời thải trừ của stavudine triphosphate trong tế bào vào khoảng 3,5 giờ. Khoảng 40% liều thuốc được đào thải dưới dạng không đổi qua nước tiểu nhờ lọc ở cầu thận và bài tiết bởi ống thận trong 12 – 24 giờ. Có thể thải loại stavudine qua thẩm phân máu, nhưng chưa rõ thẩm phân màng bụng có thải loại được stavudine không. Hệ số thanh thải stavudine tương quan với hệ số thanh thải creatinin; bởi vậy cần điều chỉnh liều stavudine ở người bệnh suy thận. Suy giảm chức năng gan không làm ảnh hưởng có ý nghĩa lâm sàng đến dược động học của stavudine.
Chỉ định điều trị
Điều trị nhiễm HIV/AIDS, dùng phối hợp với các thuốc kháng retrovirus khác. Không nên dùng stavudine đơn độc vì thuốc sẽ nhanh chóng bị đề kháng.
Liều dùng
Bệnh nhân ≥ 60kg: Uống 40mg/lần x 2 lần/ngày (mỗi lần cách nhau 12 giờ).
Bệnh nhân ≤ 60kg: Uống 30mg/lần x 2 lần/ngày (mỗi lần cách nhau 12 giờ).
Bệnh nhân suy thận:
Bệnh nhân có cân nặng ≥ 60kg:
- CrCl > 50 ml/ph: Uống 40 mg mỗi 12 giờ.
- CrCl 26-50 ml/ph: Uống 20 mg mỗi 12 giờ.
- CrCl 10-25 ml/ph: Uống 20 mg mỗi ngày.
Bệnh nhân có cân nặng ≤ 60kg:
- CrCl > 50 ml/ph: Uống 30 mg mỗi 12 giờ.
- CrCl 26-50 ml/ph: Uống 15 mg mỗi 12 giờ.
- CrCl 10-25 ml/ph: Uống 15 mg mỗi ngày.
Tác dụng không mong muốn
Rất thường gặp (>10%):
- Đau đầu.
- Ớn lạnh/sốt.
- Khó chịu, mất ngủ.
- Lo lắng.
- Trầm cảm.
- Đau bụng.
- Phát ban.
- Buồn nôn, nôn.
- Tiêu chảy.
- Viêm tụy.
- Bệnh lí thần kinh ngoại biên.
Thường gặp (1-10%):
- Giảm bạch cầu trung tính.
- Giảm tiểu cầu.
- Tăng transaminase gan.
- Đau cơ, đau lưng.
Báo cáo hậu mãi (postmarketing reports):
- Loạn dưỡng mỡ.
- Rối loạn mỡ máu.
Thận trọng và cảnh báo
Đã có những báo cáo về viêm tụy; đình chỉ tạm thời nếu nghi ngờ viêm tụy và ngừng sử dụng nếu xác nhận đúng là viêm tụy.
Nhiễm toan lactic, gan to và nhiễm mỡ nghiêm trọng đã được báo cáo khi sử dụng các chất tương tự nucleoside đơn thuần hoặc kết hợp. Các thử nghiệm ngẫu nhiên có đối chứng cho thấy rối loạn mỡ máu hoặc loạn dưỡng mỡ phát triển ở tỉ lệ cao hơn ở những bệnh nhân dùng stavudine so với các nucleoside khác (tenofovir hoặc abacavir).
Nhiễm toan lactic gây tử vong đã được báo cáo ở phụ nữ có thai đã sử dụng didanosine và stavudine với các thuốc kháng retrovirus khác. Phối hợp này chống chỉ định ở phụ nữ mang thai.
Nguy cơ hội chứng viêm phục hồi miễn dịch khi sử dụng với một số thuốc kháng retrovirus khác.
Chú ý khi sử dụng chung với thuốc khác
Stavudine có những tương tác khi dùng chung với các thuốc sau:
Atazanavir (ATV): giảm hiệu quả của atazanavir (Atazanavir: AUC giảm 87%, Cmax giảm 89%).
Chlorpropamide: có khả năng làm tăng nồng độ glucose huyết thanh (Chlorpropamide: AUC giảm 45%, Cmax giảm 35%).
Clarithromycin: chưa rõ (Stavudine: Cmax giảm 15%, Cmin giảm 41%).
Didanosine (ddI): Cmax tăng 17%.
Fluconazole: Cmin tăng 25%.
Indinavir (IDV): Stavudine: AUC tăng 24% (với indinavir và ritonavir) hoặc 14% (với indinavir đơn độc).
Methadone: giảm sinh khả dụng stavudine (Stavudine: AUC giảm 23%, Cmax giảm 44%).
Rifabutin: Stavudine: Cmax giảm 30%; Cmin tăng 105%.
Tipranavir: Stavudine: Cmax giảm 26%.
Zidovudine (AZT): giảm hiệu quả của stavudine do ức chế cạnh tranh phosphoryl hóa nội bào với stavudine, đồng thời độc tính tăng khi sử dụng đồng thời.
Chống chỉ định
Quá mẫn cảm với stavudine hoặc với bất cứ thành phần nào của thuốc
Ung thư đang điều trị bằng hóa chất.
Phối hợp với zidovudine (AZT) do tác dụng đối kháng và tăng độc tính của thuốc.
Không phối hợp với didanosine.
Các dạng bào chế thường gặp
Thuốc bột để pha dung dịch uống: 1 mg/ml (200 ml).
Viên nang: 15 mg; 20 mg; 30 mg; 40 mg.
Tham khảo thêm:
EC chấp thuận hai thuốc điều trị HIV mới Pifeltro và Delstrigo









